题目内容
黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用.SPFS可表示成Fex(OH)y(SO4)z?nH2O.工业上常用的一种制备流程为:

(1)绿矾的化学式是 ,上述绿矾与NaClO3溶液反应的离子方程式是 .
(2)测定组成:取12.10g上述SPFS溶解于水,配成200mL,分成二等份,向其中一份加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀9.32g.另一份中加入足量的还原剂(不含铁元素),将Fe3+转化为Fe2+.然后取50.00mL转化后的溶液.用0.100mol?L-1酸性高锰酸钾溶液滴定产生的Fe2+,消耗酸性高锰酸钾溶液30.00mL.
①滴定终点的现象判断是 .
②该SPFS的化学式是 .(写出解题过程)

(1)绿矾的化学式是
(2)测定组成:取12.10g上述SPFS溶解于水,配成200mL,分成二等份,向其中一份加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀9.32g.另一份中加入足量的还原剂(不含铁元素),将Fe3+转化为Fe2+.然后取50.00mL转化后的溶液.用0.100mol?L-1酸性高锰酸钾溶液滴定产生的Fe2+,消耗酸性高锰酸钾溶液30.00mL.
①滴定终点的现象判断是
②该SPFS的化学式是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)绿矾为七水硫酸亚铁,氯酸根离子具有氧化性,亚铁离子具有还原性,据此来书写方程式;
(2)①高锰酸钾具有强氧化性,把亚铁离子氧化成铁离子,当亚铁离子消耗完,再滴入高锰酸钾,显示高锰酸钾的颜色,溶液由黄色变为紫色;
②根据原子守恒和质量守恒来计算.
(2)①高锰酸钾具有强氧化性,把亚铁离子氧化成铁离子,当亚铁离子消耗完,再滴入高锰酸钾,显示高锰酸钾的颜色,溶液由黄色变为紫色;
②根据原子守恒和质量守恒来计算.
解答:
解:(1)绿矾为七水硫酸亚铁,化学式为:FeSO4?7H2O;氯酸根离子具有氧化性,亚铁离子具有还原性,二者发生的氧化还原反应为:
6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O,
故答案为:FeSO4?7H2O;6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O;
(2)①亚铁离子显浅绿色,高锰酸钾溶液显紫红色,高锰酸钾具有强氧化性,把亚铁离子氧化成铁离子,当亚铁离子消耗完,再滴入高锰酸钾,显示高锰酸钾的颜色,溶液由浅绿色变为紫红色;故答案为:溶液由浅绿色变为紫红色,且半分钟不褪色;
②100mL溶液中n(SO42-)=n(BaSO4)=
=0.04mol,
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
c(Fe2+)=5×0.100mol/L×30mL÷50mL=0.3mol/L
100mL溶液中含有n(Fe3+)=0.3mol/L×0.1L=0.03mol
根据Fex(OH)y(SO4)z?nH2O,x:z=0.03mol:0.04mol=3:4,即x=3,z=4,则利用化合价守恒得:3x=y+2z,即3×3=y+2×4,y=1,
即SPFS的化学式可写成是Fe3(OH)(SO4)4?nH2O,100mL溶液溶质为0.01mol,故0.01mol×(56×3+17+96×4+18n)g?mol-1×2=12.10g,
解得:n=2,故化学式是Fe3(OH)(SO4)4?2H2O;故答案为:Fe3(OH)(SO4)4?2H2O
6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O,
故答案为:FeSO4?7H2O;6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O;
(2)①亚铁离子显浅绿色,高锰酸钾溶液显紫红色,高锰酸钾具有强氧化性,把亚铁离子氧化成铁离子,当亚铁离子消耗完,再滴入高锰酸钾,显示高锰酸钾的颜色,溶液由浅绿色变为紫红色;故答案为:溶液由浅绿色变为紫红色,且半分钟不褪色;
②100mL溶液中n(SO42-)=n(BaSO4)=
| 9.32g |
| 233g/mol |
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
c(Fe2+)=5×0.100mol/L×30mL÷50mL=0.3mol/L
100mL溶液中含有n(Fe3+)=0.3mol/L×0.1L=0.03mol
根据Fex(OH)y(SO4)z?nH2O,x:z=0.03mol:0.04mol=3:4,即x=3,z=4,则利用化合价守恒得:3x=y+2z,即3×3=y+2×4,y=1,
即SPFS的化学式可写成是Fe3(OH)(SO4)4?nH2O,100mL溶液溶质为0.01mol,故0.01mol×(56×3+17+96×4+18n)g?mol-1×2=12.10g,
解得:n=2,故化学式是Fe3(OH)(SO4)4?2H2O;故答案为:Fe3(OH)(SO4)4?2H2O
点评:本题考查了聚合硫酸铁分子式的确定,中等难度,注意原子守恒、得失电子守恒和化合价代数和为0的运用.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、22.4 L氢气中,一定含有氢原子2NA |
| B、在常温常压下,28gCO和N2的混合气体中含有的分子数为NA |
| C、常温下,pH=1的盐酸溶液,含有H+数目是0.1NA |
| D、标准状态下,2.7g铝和足量的浓硝酸反应,转移的电子数是0.3NA |
将4molA气体和2molB气体在2L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol?L-1,下列说法中正确的是( )
| A、当容器内混合气体的密度不再发生变化时,反应即达到平衡状态 |
| B、达平衡后若升高温度,该反应的平衡常数将增大 |
| C、平衡时反应物B的转化率为15.0% |
| D、达平衡后,如果此时移走2 molA和1molB,在相同温度下再达平衡时C的浓度<0.3mol?L-1 |
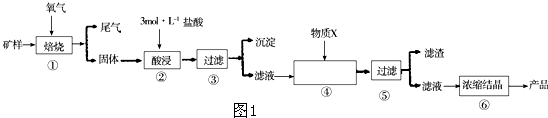
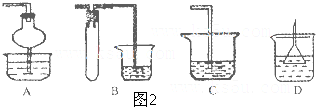
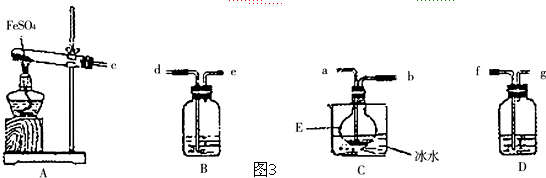
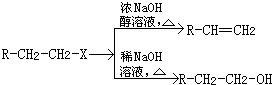
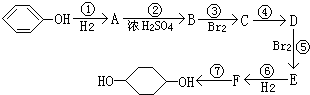
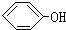 合成
合成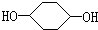 (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)