题目内容
13.下面有几种物质,请按要求回答问题.①碳酸钠溶液与沙子 ②粗盐 ③SiO2和Al2O3混合物
④水和汽油的混合物 ⑤用CCl4提取碘水中的碘
(1)分离①的操作名称为过滤.
(2)为了除去粗盐中含有Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液.
正确的操作顺序有BD
A ①②③④⑤B ⑤②④①③C ④⑤②①③D ②⑤④①③
(3)SiO2中混有少量Al2O3杂质,除去杂质所加的试剂为 盐酸或硫酸
(4)④和⑤共同使用的仪器且在其他组分分离无需使用,这种仪器是分液漏斗.
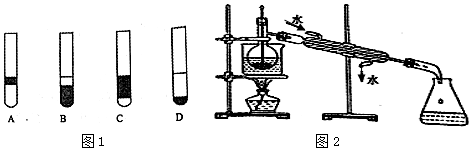
(5)在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是D(注:图1图片片中深色区为紫红色溶液)
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还需要经过蒸馏,指出图2实验装置中的错误之处.
①未垫石棉网;
②温度计插到了液体中;
③冷凝管进出水的方向颠倒.
分析 (1)沙子不溶于水,可用过滤的方法分离;
(2)除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子,所以④碳酸钠溶液必须放在⑤之后;
(3)氧化铝为两性氧化物,可与强酸溶液反应,而二氧化硅不反应;
(4)④和⑤可分别用分液、萃取的方法分离;
(5)四氯化碳密度比水大,碘易溶于四氯化碳,下层颜色较深;
(6)蒸馏时,温度计用于测量馏分的温度,且应充分冷凝.
解答 解:(1)沙子不溶于水,可用过滤的方法分离,故答案为:过滤;
(2)要先除SO42-,然后再除Ca2+,Na2CO3可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加NaOH除去Mg2+顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,过滤即可,最后加盐酸除去过量的氢氧根离子碳酸根离子,
所以操作顺序可以为:②⑤④①③或⑤②④①③或⑤④②①③,但不能为④⑤②①③,
故答案为:BD;
(3)氧化铝为两性氧化物,可与强酸溶液反应,而二氧化硅不反应,二者都与强碱反应,可加入盐酸或硫酸除杂,故答案为:盐酸或硫酸;
(4)④和⑤可分别用分液、萃取的方法分离,都用到分液漏斗分离,故答案为:分液漏斗;
(5)四氯化碳密度比水大,碘易溶于四氯化碳,下层颜色较深,由体积关系可知D正确,故答案为:D;
(6)蒸馏时,温度计用于测量馏分的温度,不能吧温度计插到了液体中,应位于支管口附近,且应充分冷凝,冷水应从下端进,上端出,
故答案为:温度计插到了液体中;冷凝管进出水的方向颠倒.
点评 本题综合考查物质的分离提纯,为高频考点,涉及粗盐的提纯、蒸馏等操作,题目难度不大,明确加入试剂的作用及先后顺序为解答关键,注意掌握除杂原则,试题培养了学生的分析能力及化学实验能力.

| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗下端管口与烧杯内壁 | |
| C. | 分液操作中,分液漏斗下端管口与烧杯内壁 | |
| D. | 用胶头滴管向试管滴加液体时,滴管尖端与试管内壁 |
| A. | CaCO3的电离方程式:CaCO3═Ca2+CO32- | |
| B. | NaHS水解:HS-+H2O═H3O++S2- | |
| C. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 用少量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O |
| 离子组 | 加入试剂 | 离子方程式 | |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | SO42-+2NH4++Ba2++2OH-=BaSO4↓+2NH3•5H2O |
| B | Mg2+、HCO3-、Cl-、 | 过量NaOH溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe3+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程.已知反应:N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1.试根据表中所列键能数据,计算a 的数值为391kJ/mol.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=a kJ/mol
②H2O(g)═H2O(l)△H=b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=(a+4b)kJ/mol.
(3)已知:HCN(aq)与NaOH(aq)反应的焓变△H=-12.1kJ•mol-1; HCl(aq)与NaOH(aq)反应的焓变△H=-55.6kJ•mol-1.则HCN在水溶液中电离的焓变△H等于+43.5kJ•mol-1.
(4)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.83kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.9kJ•mol-1;
若氢气与一氧化碳的混合气体完全燃烧可生成5.4g H2O(l),并放出114.3kJ的热量,则混合气中CO的物质的量为0.1mol(计算结果保留一位小数)
| A. | 光束穿过胶体时形成一条光亮的“通路” | |
| B. | 胶体粒子直径大小在1~100nm之间 | |
| C. | 胶体粒子可以透过滤纸 | |
| D. | 胶体粒子带有一定数目的电荷 |
| A. | 质子数为 8、中子数为 10 的氧原子:${\;}_{8}^{10}$O | |
| B. | 过氧化钠的电子式: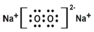 | |
| C. | 氧原子的电子排布图:1s22s22p4 | |
| D. | 次氯酸的结构式:H-Cl-O |
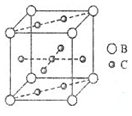 A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q .
.