题目内容
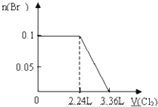
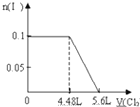
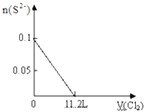
有A、B、C、D四种溶液,它们各为H2SO4、BaCl2、K2CO3、Na2SO4中的一种,分别取少量样品进行下列实验,现象为:在A中加C,无明显变化;在A中加D,无明显变化;在B中加D,生成沉淀E,并得到一种溶液;在B中加C,生成沉淀并得到一种溶液F;将少量E加入到足量F中,有气体放出.
(1)写化学式,A是 ,D是 .
(2)如果将B和C混合,离子方程式为
(3)将E加入足量F中,离子方程式为 .
(1)写化学式,A是
(2)如果将B和C混合,离子方程式为
(3)将E加入足量F中,离子方程式为
考点:无机物的推断
专题:
分析:Na2SO4和H2SO4、K2CO3均不反应,混合无明显变化,故A为Na2SO4,而C、D为H2SO4、K2CO3中的一种,B为BaCl2;将少量E加入到足量F中,有气体放出,说明E为碳酸钡,则D为K2CO3,C为H2SO4,F为盐酸溶液,以此解答.
解答:
解:Na2SO4和H2SO4、K2CO3均不反应,混合无明显变化,故A为Na2SO4,而C、D为H2SO4、K2CO3中的一种,B为BaCl2;将少量E加入到足量F中,有气体放出,说明E为碳酸钡,则D为K2CO3,C为H2SO4,F为盐酸溶液,
(1)由以上分析知:A是Na2SO4,D是K2CO3,故答案为:Na2SO4;K2CO3;
(2)氯化钡和硫酸反应的离子方程式为:Ba2++SO42-═BaSO4↓,故答案为:Ba2++SO42-═BaSO4↓;
(3)碳酸钡加入盐酸中生成二氧化碳和氯化钡,反应离子方程式为:BaCO3+2H+═Ba2++CO2↑+H2O,故答案为:BaCO3+2H+═Ba2++CO2↑+H2O.
(1)由以上分析知:A是Na2SO4,D是K2CO3,故答案为:Na2SO4;K2CO3;
(2)氯化钡和硫酸反应的离子方程式为:Ba2++SO42-═BaSO4↓,故答案为:Ba2++SO42-═BaSO4↓;
(3)碳酸钡加入盐酸中生成二氧化碳和氯化钡,反应离子方程式为:BaCO3+2H+═Ba2++CO2↑+H2O,故答案为:BaCO3+2H+═Ba2++CO2↑+H2O.
点评:本题考查学生溶液中物质之间的反应实质是离子之间的反应,根据所学知识来回答,较简单.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
要配制浓度约为2mol/LNaOH溶液100mL,下面的操作正确的是( )
| A、用托盘天平称取8gNaOH固体(NaOH固体放置于天平的托盘上),放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B、称取8gNaOH固体,放入100mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C、称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D、用50mL量筒量取40mL5mol/LNaOH溶液,倒入100mL容量瓶中,然后加蒸馏水定容直至刻度线,盖好瓶塞,反复摇匀,装瓶就行 |
某化学式为AB的离子晶体,已知5r(A2+)=4r(B2-)(各类离子晶体与阴阳离子半径比关系如图所示),经测定其密度为ρg?cm-3,其摩尔质量为Mg?mol-1,则下列有关该晶体的说法正确的是( )
| r+/r- | 配位数 | 实例 |
| 0.225~0.414 | 4 | ZnS |
| 0.414~0.732 | 6 | NaCl |
| 0.732~1.0 | 8 | CsCl |
| >1.0 | 12 | CsF |
| A、该晶体结构与ZnS晶体相似 | |||||
| B、该晶体每个晶胞中有2个A2+和B2- | |||||
C、该晶体晶胞的边长
| |||||
| D、A2+离子紧邻的B2-构成的空间结构为正方体 |
在实验室从自来水制取蒸馏水的实验中,下列说法错误的是( )
| A、蒸馏烧瓶中要放入碎瓷片防止暴沸 |
| B、温度计的水银球放在支管口稍下位置,不能插入液面 |
| C、冷凝水应该是下进上出,与蒸汽的流向相反 |
| D、开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯 |
有两气态脂肪烃的混合气体,它们都能使溴水褪色,且分子中碳原子数均小于5.1体积该混合气体完全燃烧后,可得3.6体积的CO2和3体积的水蒸气(体积在同温同压下测定),这两种烃的分子式及体积比为( )
| A、C2H4与C4H8,体比为17:53 |
| B、C2H2与C4H8,体积比为17:58 |
| C、C3H6与C4H6,体积比为2:3 |
| D、C2H4与C4H8,体积比为17:23 |
由溴乙烷制取乙二酸,依次发生反应的类型是( )
| A、取代加成水解氧化 |
| B、消去加成取代氧化 |
| C、水解消去加成水解 |
| D、消去水解取代还原 |
已知在101kPa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A、H2O(g)═H2(g)+
| ||
| B、2H2(g)+O2(g)═2H2O(l)△H=-484 kJ?mol-1 | ||
C、H2(g)+
| ||
| D、2H2(g)+O2(g)═2H2O(g)△H=+484 kJ?mol-1 |