题目内容
要配制浓度约为2mol/LNaOH溶液100mL,下面的操作正确的是( )
| A、用托盘天平称取8gNaOH固体(NaOH固体放置于天平的托盘上),放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B、称取8gNaOH固体,放入100mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C、称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D、用50mL量筒量取40mL5mol/LNaOH溶液,倒入100mL容量瓶中,然后加蒸馏水定容直至刻度线,盖好瓶塞,反复摇匀,装瓶就行 |
考点:配制一定物质的量浓度的溶液
专题:
分析:A、NaOH固体应放到小烧杯里称量,应使最后溶液的体积为100mL;
B、量筒不能用来溶解固体;
C、容量瓶只能用来配制溶液,不能用来稀释或溶解药品;
D、根据C浓V浓=C稀V稀计算出需要的浓氢氧化钠溶液的体积,结合溶液配制操作判断.
B、量筒不能用来溶解固体;
C、容量瓶只能用来配制溶液,不能用来稀释或溶解药品;
D、根据C浓V浓=C稀V稀计算出需要的浓氢氧化钠溶液的体积,结合溶液配制操作判断.
解答:
解:A、NaOH固体应放到小烧杯里称量,不能直接放到托盘里;应使最后溶液的体积为100mL,而如果用100mL量筒量取100mL蒸馏水,加入烧杯中,则最后溶液的体积将大于100mL,故A错误;
B、量筒不能受热,故不能用来溶解固体,故B错误;
C、容量瓶只能用来配制溶液,不能受热,故不能用来稀释或溶解药品,故C错误;
D、设需要的浓氢氧化钠溶液的体积为VmL,根据稀释定律C浓V浓=C稀V稀,可知:5mol/L×VmL=2mol/L×100mL,解得V=40mL,即需要的浓氢氧化钠的体积为40mL,故用50mL量筒量取40mL5mol/LNaOH溶液,倒入100mL容量瓶中,然后加蒸馏水定容直至刻度线,盖好瓶塞,反复摇匀,装瓶就行,故D正确.
故选D.
B、量筒不能受热,故不能用来溶解固体,故B错误;
C、容量瓶只能用来配制溶液,不能受热,故不能用来稀释或溶解药品,故C错误;
D、设需要的浓氢氧化钠溶液的体积为VmL,根据稀释定律C浓V浓=C稀V稀,可知:5mol/L×VmL=2mol/L×100mL,解得V=40mL,即需要的浓氢氧化钠的体积为40mL,故用50mL量筒量取40mL5mol/LNaOH溶液,倒入100mL容量瓶中,然后加蒸馏水定容直至刻度线,盖好瓶塞,反复摇匀,装瓶就行,故D正确.
故选D.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和配制方法,属于基础型题目,难度不大.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式为( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
氧化还原反应的实质是( )
| A、得到氧元素与失去氧元素 |
| B、有无新物质生成 |
| C、化合价的升降 |
| D、电子的得失或共用电子对的偏移 |
将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是( )
| A、银、干冰、硫酸、烧碱、食盐 |
| B、碘酒、冰、盐酸、烧碱、食盐 |
| C、氢气、二氧化硫、硝酸、纯碱、硝酸钾 |
| D、铜、氧化铜、醋酸、石灰水、氯化铜 |
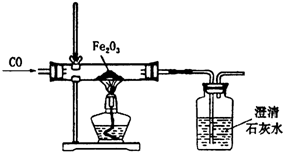 某课外活动小组在实验室条件下探究CO与Fe2O3反应的产物情况,实验设计如图所示.
某课外活动小组在实验室条件下探究CO与Fe2O3反应的产物情况,实验设计如图所示.