题目内容
下表是某加碘盐包装袋上的部分文字说明:
根据这一说明某学生作出如下判断,其中正确的是( )
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | (35±15)mg?kg-1(以I计) |
| 食用方法 | 菜未烧熟不宜加入加碘盐,菜烧熟后加入加碘盐最佳. |
| A、此食盐是纯净物 |
| B、“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定 |
| C、“加碘食盐”中的“碘”是指碘单质 |
| D、1kg此食盐中含碘酸钾(35±15)mg |
考点:氯、溴、碘及其化合物的综合应用,混合物和纯净物
专题:卤族元素
分析:A.只有一种物质组成为纯净物;
B.由食用方法可知,菜烧熟后加入加碘盐最佳,以此分析其性质;
C.“加碘食盐”中加入碘酸钾;
D.(35±15)mg?kg-1(以I计)为碘元素的含量.
B.由食用方法可知,菜烧熟后加入加碘盐最佳,以此分析其性质;
C.“加碘食盐”中加入碘酸钾;
D.(35±15)mg?kg-1(以I计)为碘元素的含量.
解答:
解:A.由配料可知,食盐中含氯化钠(NaCl)、碘酸钾(KIO3),为混合物,故A错误;
B.由食用方法可知,菜烧熟后加入加碘盐最佳,则碘酸钾受热不稳定,所以菜未烧熟不宜加入加碘盐,故B正确;
C.“加碘食盐”中加入碘酸钾,碘元素存在于化合物中,不是碘单质,碘易升华,则不加碘单质,故C错误;
D.由包装袋上的含碘量可知,(35±15)mg?kg-1(以I计)为碘元素的含量,而不是碘酸钾的含量,故D错误;
故选B.
B.由食用方法可知,菜烧熟后加入加碘盐最佳,则碘酸钾受热不稳定,所以菜未烧熟不宜加入加碘盐,故B正确;
C.“加碘食盐”中加入碘酸钾,碘元素存在于化合物中,不是碘单质,碘易升华,则不加碘单质,故C错误;
D.由包装袋上的含碘量可知,(35±15)mg?kg-1(以I计)为碘元素的含量,而不是碘酸钾的含量,故D错误;
故选B.
点评:本题考查含碘食盐,为高频考点,侧重学生分析能力及知识迁移应用能力的考查,把握加碘盐包装袋上的部分文字说明为解答的关键,注意信息的分析与应用,题目难度不大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
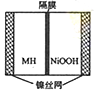 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),下列有关说法中不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),下列有关说法中不正确的是( )| A、放电时正极反应为:NiOOH+H2O+e-→Ni(OH)2+OH- |
| B、电池的电解液可为KOH溶液 |
| C、充电时负极反应为:MH+OH-→H2O+M+e- |
| D、MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
下列常用实验仪器中,不能直接用于混合物的分离或提纯的是( )
| A、分液漏斗 | B、普通漏斗 |
| C、蒸馏烧瓶 | D、量筒 |
下列说法不正确的是( )
| A、能用酒精、汽油将洒在衣服上的油汤除去,实际上是用萃取的原理 |
| B、从热饱和FeSO4溶液中得到FeSO4?7H2O晶体的操作是冷却结晶 |
| C、实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | ||||
| B、室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | ||||
| C、氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | ||||
D、5NH4NO3
|