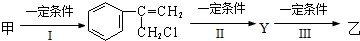题目内容
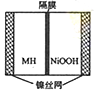 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),下列有关说法中不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),下列有关说法中不正确的是( )| A、放电时正极反应为:NiOOH+H2O+e-→Ni(OH)2+OH- |
| B、电池的电解液可为KOH溶液 |
| C、充电时负极反应为:MH+OH-→H2O+M+e- |
| D、MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
考点:化学电源新型电池
专题:电化学专题
分析:镍氢电池中主要为KOH作电解液充电时,阳极反应:Ni(OH)2+OH-=NiOOH+H2O+e-阴极反应:M+H2O+e-=MH+OH-,总反应:M+Ni(OH)2=MH+NiOOH;
放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MH+OH--e-=M+H2O,总反应:MH+NiOOH=M+Ni(OH)2 .
以上式中M为储氢合金,MH为吸附了氢原子的储氢合金.
放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MH+OH--e-=M+H2O,总反应:MH+NiOOH=M+Ni(OH)2 .
以上式中M为储氢合金,MH为吸附了氢原子的储氢合金.
解答:
解:A、放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,故A正确;
B、为了防止MH被氢离子氧化,镍氢电池中电解液为碱性溶液,主要为KOH作电解液,故B正确;
C、充电式,负极作阴极,阴极反应为M+H2O+e-=MH+OH-,故C错误;
D、M为储氢合金,MH为吸附了氢原子的储氢合金,储氢材料,其氢密度越大,电池的能量密度越高,故D正确;
故选C.
B、为了防止MH被氢离子氧化,镍氢电池中电解液为碱性溶液,主要为KOH作电解液,故B正确;
C、充电式,负极作阴极,阴极反应为M+H2O+e-=MH+OH-,故C错误;
D、M为储氢合金,MH为吸附了氢原子的储氢合金,储氢材料,其氢密度越大,电池的能量密度越高,故D正确;
故选C.
点评:本题考查了原电池和电解池原理,明确题给信息的含义是解本题关键,难点的电极反应式的书写,题目难度中等.

练习册系列答案
相关题目
1gH2燃烧生成液态水放出142.9KJ的热量,表示该反应的热化学方程式正确的是( )
| A、2H2(g)+O2(g)=2H2O(l)△H=-142.9kJ?mol-1 |
| B、2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1 |
| C、2H2+O2=2H2O△H=-571.6kJ?mol-1 |
| D、H2(g)+1/2O2(g)=H2O(g)△H=-285.8kJ?mol-1 |
一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
下列说法正确的是( )
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A、该反应的正反应为放热反应 |
| B、达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小 |
| C、容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长 |
| D、若起始时向容器Ⅰ中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行 |
用固体配制100毫升一定物质的量浓度的溶液时,必须用到的仪器是( )
A、 分液漏斗 |
B、 圆底烧瓶 |
C、 容量瓶 |
D、 集气瓶 |
下表是某加碘盐包装袋上的部分文字说明:
根据这一说明某学生作出如下判断,其中正确的是( )
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | (35±15)mg?kg-1(以I计) |
| 食用方法 | 菜未烧熟不宜加入加碘盐,菜烧熟后加入加碘盐最佳. |
| A、此食盐是纯净物 |
| B、“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定 |
| C、“加碘食盐”中的“碘”是指碘单质 |
| D、1kg此食盐中含碘酸钾(35±15)mg |
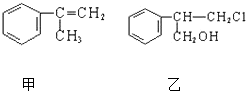 由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):