题目内容
(1)在BF3分子中,F-B-F的键角是 ,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为 ;
(2)H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为 .
(3)CO和N2是等电子体,CO和N2的结构均可表示为A≡B的形式(A、B可表示相同元素的原子也可表示不同元素的原子).如表是两者的键能数据:(单位:kJ/mol)
结合数据说明CO比N2活泼的原因: .
(2)H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为
(3)CO和N2是等电子体,CO和N2的结构均可表示为A≡B的形式(A、B可表示相同元素的原子也可表示不同元素的原子).如表是两者的键能数据:(单位:kJ/mol)
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
考点:键能、键长、键角及其应用,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:(1)价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果,先判断价层电子对数,再确定构型;价层电子对互斥理论判断其σ电子对和孤电子对数目;
(2)一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力;
(3)根据提供的键能计算各物质中的第一个π键的键能,键能越大越稳定.
(2)一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力;
(3)根据提供的键能计算各物质中的第一个π键的键能,键能越大越稳定.
解答:
解:(1)BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=
(a-xb)=
(0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°;BF3和过量NaF作用可生成NaBF4,BF4-中B原子的价层电子对=4+
=4,该离子中不含孤电子对,为正四面体结构;
故答案为:120°;正四面体;
(2)H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大;
故答案为:H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小;
(3)根据表中键能知,CO中第一个π键的键能是1071.9kJ/mol-357.7kJ/mol-798.9kJ/mol=273.1kJ/mol,
N2中第一个π键的键能是941.7kJ/mol-154.8kJ/mol-418.4kJ/mol=524kJ/mol,
CO中第一个π键的键能是273.1kJ/mol,N2中第一个π键的键能是524kJ/mol,CO中第一个π键的键能较小,所以CO的第一个键比N2更容易断,所以一氧化碳比氮气活泼,
故答案为:断裂一个π键所需的能量,CO比N2小很多.
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:120°;正四面体;
(2)H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大;
故答案为:H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小;
(3)根据表中键能知,CO中第一个π键的键能是1071.9kJ/mol-357.7kJ/mol-798.9kJ/mol=273.1kJ/mol,
N2中第一个π键的键能是941.7kJ/mol-154.8kJ/mol-418.4kJ/mol=524kJ/mol,
CO中第一个π键的键能是273.1kJ/mol,N2中第一个π键的键能是524kJ/mol,CO中第一个π键的键能较小,所以CO的第一个键比N2更容易断,所以一氧化碳比氮气活泼,
故答案为:断裂一个π键所需的能量,CO比N2小很多.
点评:本题考查了键角的判断、分子空间构型的判断、键能的比较等,题目综合性较大,难度较大,侧重于考查学生对数据的处理能力.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
1gH2燃烧生成液态水放出142.9KJ的热量,表示该反应的热化学方程式正确的是( )
| A、2H2(g)+O2(g)=2H2O(l)△H=-142.9kJ?mol-1 |
| B、2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1 |
| C、2H2+O2=2H2O△H=-571.6kJ?mol-1 |
| D、H2(g)+1/2O2(g)=H2O(g)△H=-285.8kJ?mol-1 |
下表是某加碘盐包装袋上的部分文字说明:
根据这一说明某学生作出如下判断,其中正确的是( )
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | (35±15)mg?kg-1(以I计) |
| 食用方法 | 菜未烧熟不宜加入加碘盐,菜烧熟后加入加碘盐最佳. |
| A、此食盐是纯净物 |
| B、“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定 |
| C、“加碘食盐”中的“碘”是指碘单质 |
| D、1kg此食盐中含碘酸钾(35±15)mg |
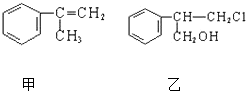 由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):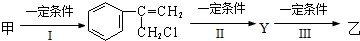

 Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素.已知:
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素.已知:

