题目内容
15.向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别为OA<AB,OA=AB,OA>AB,则下列分析与判断正确的是(不计CO2溶解)( )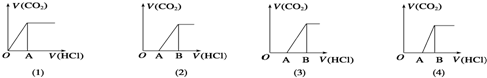
| A. | M中只有一种溶质的有 (1)和(3) | B. | M中有两种溶质的只有(2) | ||
| C. | (2)图显示M中c(NaHCO3)>c(Na2CO3) | D. | (4)图显示M中c(NaHCO3)>c(Na2CO3) |
分析 图(1)中加入盐酸即有CO2生成,说明溶质只有一种,即NaHCO3;
图(2)中OA<AB,说明溶液M中含有Na2CO3和NaHCO3两种溶质;
图(3)中OA=AB,说明溶质只有Na2CO3;
图(4)中OA>AB,说明溶液M中含有NaOH和Na2CO3两种溶质,发生的反应为NaOH+HCl=NaCl+H2O,Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+CO2+H2O,以此解答.
解答 解:A.图(1)中加入盐酸即有CO2生成,说明溶质只有一种,即NaHCO3;图(3)中OA=AB,说明溶质只有Na2CO3,故A正确;
B.图(2)中OA<AB,说明溶液M中含有Na2CO3和NaHCO3两种溶质,图(4)中OA>AB,说明溶液M中含有NaOH和Na2CO3两种溶质,故B错误;
C.图(2)中OA<AB,说明溶液M中含有Na2CO3和NaHCO3两种溶质,只有AB>2OA时,才能得出M中c(NaHCO3)>c(Na2CO3),故C错误;
D.图(4)中OA>AB,说明溶液M中含有NaOH和Na2CO3两种溶质,不存在NaHCO3,故D错误.
故选A.
点评 本题主要考查了图象和数据的分析及根据化学方程式进行计算,侧重于学生的分析能力和计算能力的考查,注意守恒法在解答中的应用,需明确反应后溶质的可能成分来比较,难度中等.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
5.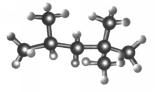 “辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )
“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )
 “辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )
“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )| A. | 1,1,3,3-四甲基丁烷 | B. | 2,2,4-甲基庚烷 | ||
| C. | 2,4,4-三甲基戊烷 | D. | 2,2,4-三甲基戊烷 |
6.羟胺(NH2OH)是一种还原剂.现用25.00mL0.049mol•L-1的羟胺的酸性溶液跟足量的Fe2(SO4)3溶液在煮沸条件下反应,生成Fe2+离子恰好与24.5mL0.020049mol•L-1 的酸性KMnO4溶液完全作用生成Fe2(SO4)3,KMnO等物质,则上述反应中羟胺的氧化产物是( )
| A. | N2O | B. | N2 | C. | NO | D. | NO2 |
7.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑.则下列判断不正确的是( )
| A. | 若有0.2mol氧化剂反应,则转移电子的物质的量为1.0mol | |
| B. | 若氧化产物比还原产物多0.35mol,生成8.96LN2(标准状况) | |
| C. | 若氧化产物比还原产物多0.35mol,有0.050molKNO3被氧化 | |
| D. | KNO3的氧化性强于N2 |
4.由CH4、O2、N2组成的混合气体在同温、同压下与CO的密度相同,则该混合气体中CH4、O2、N2的体积比可能是( )
| A. | 1:1:1 | B. | 1:1:3 | C. | 1:3:1 | D. | 3:1:1 |
5.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 100mL 8mol/LFeCl3溶液完全反应可制得0.8NA 个Fe(OH)3胶粒 | |
| B. | 0.1 mol 16OD-离子含有的电子、中子数均为1.0NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
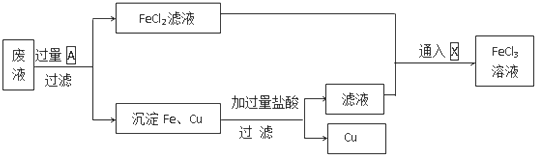
 有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系:
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系: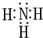 .
.