题目内容
4.由CH4、O2、N2组成的混合气体在同温、同压下与CO的密度相同,则该混合气体中CH4、O2、N2的体积比可能是( )| A. | 1:1:1 | B. | 1:1:3 | C. | 1:3:1 | D. | 3:1:1 |
分析 由于CO与N2具有相同的相对分子质量,所以CH4、O2、N2混合气体的平均相对分子质量仅由CH4、O2来决定,N2的量可以任意.用十字交叉法可以得出结果.
解答 解:由于CO与N2具有相同的相对分子质量,故CH4、O2、N2混合气体的平均相对分子质量仅由CH4、O2来决定,N2的量可以任意.由交叉法:
由十字交叉法可求得CH4和O2体积比为1:3(CO的量可以任意),混合气体的平均分子量为28.
故选C.
点评 解决问题时,要注意认真分析,寻求最佳方法,节省时间.

练习册系列答案
相关题目
15.向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别为OA<AB,OA=AB,OA>AB,则下列分析与判断正确的是(不计CO2溶解)( )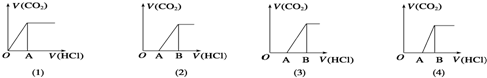

| A. | M中只有一种溶质的有 (1)和(3) | B. | M中有两种溶质的只有(2) | ||
| C. | (2)图显示M中c(NaHCO3)>c(Na2CO3) | D. | (4)图显示M中c(NaHCO3)>c(Na2CO3) |
12.关于钠及其化合物的说法正确的是( )
| A. | 将钠块投入到硫酸铜溶液中,可析出单质铜 | |
| B. | 将钠块长时间暴露在空气中的最终产物是Na2CO3 | |
| C. | Na2O与Na2O2阴阳离子个数比相同 | |
| D. | Na2O2能使品红溶液褪色且原理与SO2相同 |
19.下列说法正确的是( )
| A. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| B. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| C. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污渍 | |
| D. | 氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂 |
9.下列化合物中,属于酸式盐的是( )
| A. | NaCl | B. | NaHCO3 | C. | Cu(OH)2 | D. | H2SO4 |
14.铁铜单质及其化合物的应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:
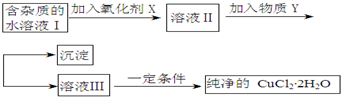
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
请回答下列问题:
(1)下列最适合作氧化剂X的是C
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入的物质Y是CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3]如果不用物质Y而直接用可溶性碱溶液不能 (填“能”或者“不能”)达到目的.若不能,试解释原因加碱使Fe3+沉淀的同时也能使Cu2+沉淀(若填“能”,此空不用回答)
(3)最后不能(填“能”或者“不能”)直接蒸发得到CuCl2•2H2O?若不能,应该如何操作才能得到CuCl2•2H2O应在HCl气流中加热蒸发结晶(若填“能”,此空不用回答)
(4)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀
(5)若向溶液Ⅱ中加入镁粉,产生的气体是氢气,试解释原因镁粉与氯化铁、氯化铜水解生成的氢离子反应生成氢气.

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
(1)下列最适合作氧化剂X的是C
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入的物质Y是CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3]如果不用物质Y而直接用可溶性碱溶液不能 (填“能”或者“不能”)达到目的.若不能,试解释原因加碱使Fe3+沉淀的同时也能使Cu2+沉淀(若填“能”,此空不用回答)
(3)最后不能(填“能”或者“不能”)直接蒸发得到CuCl2•2H2O?若不能,应该如何操作才能得到CuCl2•2H2O应在HCl气流中加热蒸发结晶(若填“能”,此空不用回答)
(4)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀
(5)若向溶液Ⅱ中加入镁粉,产生的气体是氢气,试解释原因镁粉与氯化铁、氯化铜水解生成的氢离子反应生成氢气.