题目内容
1.下列有关说法正确的是( )| A. | 饱和氯水中Cl-、N、Na+、S可以大量存在 | |
| B. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| C. | 向无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色,说明原溶液中有I- | |
| D. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═S+2I-+4H+ |
分析 A.饱和氯水具有强氧化性,能够氧化硫;
B.氯气与铁加热反应生成氯化铁;
C.紫色的为碘单质,说明是碘离子被氧化成后生成的;
D.反应生成硫酸根离子,不是亚硫酸根离子.
解答 解:A.硫与氯水发生氧化还原反应,不能大量共存,故A错误;
B.铁与氯气能够发生反应:3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故B错误;
C.向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色,说明有碘单质生成,故原溶液中有I-,故C正确;
D.SO2通入碘水中,反应生成硫酸和碘化氢,正确的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+,故D错误;
故选C.
点评 本题考查了离子方程式的书写,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
12.原子利用率=期望产物的总质量与生成物的总质量之比,原子利用率越高对环境污染越小.在下列制备环氧乙烷的反应中,原子利用率最高的是( )
| A. |  $\stackrel{催化剂}{→}$ $\stackrel{催化剂}{→}$ +HOCH2═O═CH2OH+2H2O +HOCH2═O═CH2OH+2H2O | B. | CH2═CH2+Cl2+Ca(OH)2? +CaCl2+H2O +CaCl2+H2O | ||
| C. | CH2═CH2+ (过氧乙酸)? (过氧乙酸)? +C3HCOCH +C3HCOCH | D. | 2CH2═CH2+O2$\stackrel{催化剂}{→}$ |
9.一种塑料抗氧化剂C可通过下列反应合成:

下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 物质A中所有碳原子有可能位于同一平面 | |
| B. | 物质B可与4molH2发生加成反应 | |
| C. | 用酸性KMnO4溶液鉴别抗氧化剂C中是否含有CH3(CH2)17OH | |
| D. | B生成C的反应类型为取代反应 |
16.图为烃分子的球棍模型,“大球”表示碳原子,“小球”表示氢原子.下列说法正确的是( )
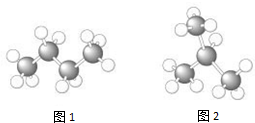

| A. | 图1表示的烃叫丙烷 | |
| B. | 图2烃分子的结构简式为CH3CH2CH2CH3 | |
| C. | 图1与图2表示的是同一种物质 | |
| D. | 图1与图2表示的物质互为同分异构体 |
6.有关元素X、Y、Z、D、E的信息如下:
请回答下列问题(用化学用语表示):
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)比较Y与Z的氢化物的稳定性HCl>H2S(用化学式表示).
(3)E元素与Y元素可形成EY2和EY3两种化合物,则下列说法中正确的是②③(填序号)
①通常实验室配制EY3溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4QkJ/mol.
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式O2+2H2O+4e-=4OH-.
| 元素 | 有关信息 |
| X | 元素主要化合价-2,原子半径为0.0074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 单质在X的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| D | 最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中的常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)比较Y与Z的氢化物的稳定性HCl>H2S(用化学式表示).
(3)E元素与Y元素可形成EY2和EY3两种化合物,则下列说法中正确的是②③(填序号)
①通常实验室配制EY3溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4QkJ/mol.
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式O2+2H2O+4e-=4OH-.
6.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4溶液中,c(NH4+)由大到小的顺序是②>①>④>③ | |
| B. | 常温下0.4 mol/L CH3COOH溶液和0.2 mol/L NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度大小顺序为:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol/L(NH4)2Fe(SO4)2溶液:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol/L | |
| D. | 室温下,向0.1 mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
7.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 1 L 0.1 mol•L-1 CuSO4溶液中含有0.1NA个Cu 2+ | |
| B. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 12 g石墨烯(单层石墨)中含有C-C的个数为1.5NA | |
| D. | 孤对电子对数均为NA的H2S和H2O在标准状况下占有体积相同 |
