题目内容
17.与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,请回答下列问题:(1)该电池放电时生成+3价铁的化合物,则电池放电时正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3↓+5OH-;
(2)完成制备电池正极材料过程中某一反应的化学方程式:
2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O
(3)FeO42-具有强氧化性,在其钾盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式为4 FeO42-+20 H+=4Fe3++3O2↑+10H2O.
分析 (1)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,正极上FeO42-得电子和H2O反应生成Fe(OH)3;
(2)反应中NaClO是氧化剂,还原产物是NaCl,根据元素守恒,可知反应式中需要补充NaCl和H2O,根据化合价升降法配平方程;
(3)FeO42- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,说明有Fe3+生成,并有无色气体产生,根据电子转移守恒,只能为O元素被氧化,故还生成O2,配平书写离子方程式.
解答 解:(1)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,正极上FeO42-得电子和H2O反应生成Fe(OH)3,电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5 OH-,故答案为:FeO42-+4H2O+3e-=Fe(OH)3↓+5OH-;
(2)反应中FeCl3→Na2FeO4,铁元素化合价由+3价升高为+6价,化合价总升高3价,NaClO→NaCl,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故FeCl3系数为2,NaClO系数为3,由铁元素守恒可知 Na2FeO4系数为2,由氯元素守恒可知NaCl系数为2×3+3=9,根据钠元素守恒可知NaOH系数为9+2×2=13,由氢元素守恒可知H2O系数为5,配平方程式为2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,故答案为:2、10、3、2、9NaCl、5H2O;(3)FeO42- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,说明有Fe3+生成,并有无色气体产生,根据电子转移守恒,只能为O元素被氧化,故还生成O2,反应离子方程式为:4 FeO42-+20 H+=4Fe3++3O2↑+10H2O,
故答案为:4 FeO42-+20 H+=4Fe3++3O2↑+10H2O.
点评 本题考查化学反应及电极反应的书写,为高考常见题型,侧重氧化还原反应的离子反应考查,注意电子、电荷守恒,注重化学用语的夯实训练,题目难度不大.

| A. | 1 L 0.1 mol•L-1 CuSO4溶液中含有0.1NA个Cu 2+ | |
| B. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 12 g石墨烯(单层石墨)中含有C-C的个数为1.5NA | |
| D. | 孤对电子对数均为NA的H2S和H2O在标准状况下占有体积相同 |
| A. | 在墙壁刚粉刷过石灰浆的室内生一炭火盆,墙壁会“冒汗” | |
| B. | 以二氧化硅为主要原料制造光导纤维 | |
| C. | 碳炉边放盆水,可防止煤气中毒 | |
| D. | 用干冰进行人工降雨 |
| A. | 150mL 1mol/L NaCl 溶液 | B. | 75mL 2mol/L CaCl2溶液 | ||
| C. | 150mL 2mol/L KCl 溶液 | D. | 75mL 1mol/L AlCl3溶液 |
| A. | 硫酸亚铁 | B. | 氯水 | C. | 食盐 | D. | 漂白粉 |
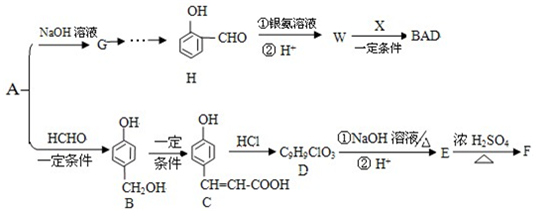
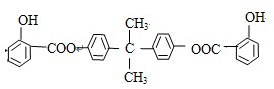
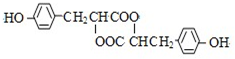
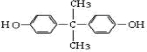 ,推测B的核磁共振氢谱中显示有5种不同化学环境的氢原子.
,推测B的核磁共振氢谱中显示有5种不同化学环境的氢原子. .
.