题目内容
14.下列说法正确的是( )| A. | 酸式盐的溶液一定显碱性 | |
| B. | 只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液是中性的 | |
| C. | 纯水呈中性时因为水中c(H+)=c(OHˉ) | |
| D. | 碳酸溶液中氢离子的物质的量浓度是碳酸根离子物质的量浓度的2倍 |
分析 A.弱酸的酸式盐存在电离和水解,溶液酸碱性取决于电离程度和水解程度大小;
B.酸碱强弱不同,元数不同酸碱性不同;
C.中性溶液中氢离子的浓度等于氢氧根离子的浓度;
D.碳酸是弱酸,在溶液中只能部分电离.
解答 解:A.弱酸的酸式盐存在电离和水解,溶液酸碱性取决于电离程度和水解程度大小,若NaHSO3溶液呈酸性,NaHCO3溶液呈碱性,故A错误;
B.酸碱强弱不同,元数不同酸碱性不同,如醋酸和氢氧化钠反应生成醋酸钠溶液显碱性,故B错误;
C.中性溶液中氢离子的浓度等于氢氧根离子的浓度,所以纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等,故C正确;
D.碳酸是弱酸部分电离,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,且主要以第一步电离为主,则氢离子浓度大于碳酸根离子浓度的2倍,故D错误;
故选C.
点评 本题考查了盐类水解和弱酸的电离的分析判断、溶液酸碱性的理解应用,题目难度不大,注意溶液酸碱性取决于氢离子、氢氧根离子浓度大小,不能直接用pH判断,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
6.Fe(NO3)2溶液中滴入稀H2SO4后,溶液颜色将会( )
| A. | 不变 | B. | 由浅绿变棕黄 | C. | 颜色变浅 | D. | 由绿变深绿 |
2.常温下由CO、H2和O2组成的混合气体,测得该混合气体对氢气的相对密度为14,则原混合气体中CO、H2和O2的体积比为( )
| A. | 1:2:15 | B. | 1:1:13 | C. | 1:2:13 | D. | 2:13:5 |
9.三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用. NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式:4NH3+3F2=NF3+3NH4
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是NH3能形成氢键,NF3只有范德华力
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1)
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为Na3AlF6其中心离子是Al,配位数为6.
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1 ),回答下面各题:
①在周期表中,最可能处于同一族的是R和U.
②T元素最可能是P区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为平面正三角形,其中心原子的杂化方式为sp2.
(1)写出制备 NF3的化学反应方程式:4NH3+3F2=NF3+3NH4
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是NH3能形成氢键,NF3只有范德华力
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1)
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为Na3AlF6其中心离子是Al,配位数为6.
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是P区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为平面正三角形,其中心原子的杂化方式为sp2.
19.一定质量的有机物A与足量金属钠反应,可得V1升气体.等质量的A与足量的碳酸氢钠溶液反应,可得V2升气体.如果在同温同压下,V1=V2,则A可能是下列物质中的( )
| A. | HO-CH2-CH2-CHO | B. | HOOC-COOH | C. | HO-CH2-CH2-COOH | D. | CH3-COOH |
4.A、B、C是元素周期表中相邻的三种元素,A和B同周期,B和C同主族,三种元素原子最外层电子数之和为14,核内质子数之和为28,则A、B、C三种元素分别是( )
| A. | N、P、O | B. | Li、Be、Mg | C. | C、N、P | D. | O、C、F |
 .
.
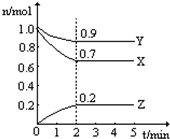 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: