题目内容
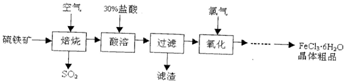
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3?6H2O)的某种工艺流程如下:
回答下列问题:
(1)硫铁矿“焙烧”中反应的化学方程式为:3FeS2+8O2
□+6SO2,则□中的化学式为 ,反应中化合价升高的元素有 .
(2)“酸溶”中反应的化学方程式为
(3)“过滤”后滤液中金属阳离子有(写离子符号)
(4)“氧化”中反应的离子方程式为 .

回答下列问题:
(1)硫铁矿“焙烧”中反应的化学方程式为:3FeS2+8O2
| ||
(2)“酸溶”中反应的化学方程式为
(3)“过滤”后滤液中金属阳离子有(写离子符号)
(4)“氧化”中反应的离子方程式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:硫铁矿通入空气煅烧生成的铁的氧化物依据化学方程式定量关系和一种守恒判断为四氧化三铁,加入盐酸溶解过滤得到滤液为氯化铁、氯化亚铁溶液,通入氯气氧化亚铁离子,通过蒸发浓缩冷却结晶过滤洗涤得到氯化铁晶体粗品;
(1)依据元素守恒计算书写化学式,标注因素化合价判断化合价升高的元素;
(2)四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水;
(3)过滤得到溶液中含有亚铁离子、铁离子;
(4)氯气氧化亚铁离子生成铁离子.
(1)依据元素守恒计算书写化学式,标注因素化合价判断化合价升高的元素;
(2)四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水;
(3)过滤得到溶液中含有亚铁离子、铁离子;
(4)氯气氧化亚铁离子生成铁离子.
解答:
解:硫铁矿通入空气煅烧生成的铁的氧化物依据化学方程式定量关系和一种守恒判断为四氧化三铁,加入盐酸溶解过滤得到滤液为氯化铁、氯化亚铁溶液,通入氯气氧化亚铁离子,通过蒸发浓缩冷却结晶过滤洗涤得到氯化铁晶体粗品;
(1)依据元素守恒计算书写化学式为Fe3O4,标注因素化合价判断化合价升高的元素为Fe、S,故答案为:Fe3O4;Fe、S;
(2)四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水,反应的化学方程式为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,故答案为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(3)四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水,过滤得到溶液中含有亚铁离子、铁离子,故答案为:Fe2+、Fe3+;
(4)氯气氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
(1)依据元素守恒计算书写化学式为Fe3O4,标注因素化合价判断化合价升高的元素为Fe、S,故答案为:Fe3O4;Fe、S;
(2)四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水,反应的化学方程式为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,故答案为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(3)四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水,过滤得到溶液中含有亚铁离子、铁离子,故答案为:Fe2+、Fe3+;
(4)氯气氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评:本题考查了物质分离和提纯的方法,实验操作,流程分析,掌握物质性质和除杂原则是解题关键,题目较简单.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
下列离子方程式正确的是( )
| A、石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | ||||
B、向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O(沸水)
| ||||
| C、氢氧化铜与稀硫酸反应:H++OH-═H2O | ||||
| D、碳酸氢钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
以锌片和铜片为两级,以稀硫酸为电解质溶液组成原电池,当导线中通过2mol电子时,下列说法正确的是( )
| A、锌片溶解了1mol电子时,铜片上析出了1mol H2 |
| B、两级上溶解和析出的物质的量相等 |
| C、锌片溶解了31g,铜片上析出了1g H2 |
| D、锌片溶解了1mol,硫酸消耗了1mol |
若NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、在同温同压时,相同体积的任何气体所含的原子数目相同 |
| B、将49gH2SO4溶于1L水中,所得溶液的物质的量浓度为0.5mol?L-1 |
| C、标准状况下,11.2L水所含的分子数为0.5NA |
| D、18g NH4+含有的电子数为10NA |
在含有FeCl3、FeCl2、AlCl3、NaCl的混合溶液中,加入足量的Na2O2固体,搅拌充分反应后,再加入过量盐酸,溶液中离子数目无变化的是( )
| A、Na+ |
| B、Al3+ |
| C、Fe2+ |
| D、Fe3+ |
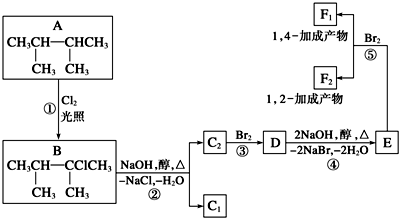
 如图,按照图片中的化学式,推导出单体.
如图,按照图片中的化学式,推导出单体.