题目内容
3.将一定量的NaCl溶于90g水中,使每10个水分子中含有一个Cl-,则该NaCl的物质的量是( )| A. | 0.05mol | B. | 0.1mol | C. | 0.25mol | D. | 0.5mol |
分析 根据n=$\frac{m}{M}$计算90g水的物质的量,进而计算氯离子物质的量,而氯离子物质的量为氯化镁的2倍,据此计算氯化镁物质的量.
解答 解:90g水的物质的量=$\frac{90g}{18g/mol}$=5mol,使每10个水分子中含有一个Cl-,则氯离子物质的量=$\frac{5mol}{10}$=0.5mol,
则NaCl的物质的量=0.5mol,
故选D.
点评 本题考查微粒数目的有关计算,明确电解质与电解质离子关系即可解答.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
13. 已知:Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
已知:Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
 已知:Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
已知:Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283 kJ | |
| B. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)△H=+452 kJ/mol | |
| C. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| D. | CO(g)与Na2O2(s)反应生成1molNa2CO3(s)时放出509kJ的热量 |
11.下列说法中,正确的是( )
| A. | 单质碳具有还原性 | |
| B. | 木炭燃烧时吸收大量的热 | |
| C. | 用活性炭可除去硬水中的氯化钙杂质 | |
| D. | 金刚石、石墨都是由碳原子构成的,都很硬 |
8.对于某些离子的检验及结论正确的是( )
| A. | 加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32- | |
| B. | 加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42- | |
| C. | 某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+ | |
| D. | 某溶液的焰色反应为黄色,则该溶液中一定有Na+ |
15.某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ.为确认该溶液组成进行如下实验:①取20.0mL该溶液,加入25.0mL 4.00mol•L-1NaOH溶液,有白色沉淀、无剌激气味气体生成.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100mL,测得滤液中c(OHˉ)为0.20mol•L-1;②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g.由此可得出关于原溶液组成的正确结论是( )
| A. | 一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+ | |
| B. | 一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+ | |
| C. | c(Clˉ)为 4.00mol•L-1,c(Al3+)为1.00 mol•L-1 | |
| D. | c(Mg2+)为 1.00mol•L-1,c(Na+)为 0.50 mol•L-1 |
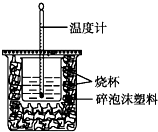 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: