题目内容
可确认发生了化学平衡移动的是( )
| A、由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 |
| B、有气态物质参加的可逆反应达到平衡后,改变了压强 |
| C、化学反应速率发生了改变 |
| D、可逆反应达到平衡后,使用催化剂 |
考点:化学平衡建立的过程,化学平衡状态的判断
专题:化学平衡专题
分析:可根据化学平衡移动的因素以及可以反应的类型来综合分析,一定条件下,当改变其中一个条件,平衡向减弱这种改变的方向进行;
A、当平衡混合物各组分的浓度发生同等程度的变化时,化学平衡未必发生移动,各组分的浓度发生不同程度的变化时,就说明化学平衡向某个方向;
B、反应前后气体 物质的量不变的反应,平衡移动,压强不变;
C、正逆反应速率同等程度改变,平衡不动;
D、催化剂改变反应速率不改变化学平衡;
A、当平衡混合物各组分的浓度发生同等程度的变化时,化学平衡未必发生移动,各组分的浓度发生不同程度的变化时,就说明化学平衡向某个方向;
B、反应前后气体 物质的量不变的反应,平衡移动,压强不变;
C、正逆反应速率同等程度改变,平衡不动;
D、催化剂改变反应速率不改变化学平衡;
解答:
解:A.当平衡混合物各组分的浓度发生不同程度的变化时,就说明化学平衡向某个方向(正反应方向或逆反应方向)进行,即化学平衡发生了移动,当平衡混合物各组分的浓度发生同等程度的变化时,化学平衡未必发生移动,如对于I2+H2=2HI来说,当增大加强减小体积时,就不会发生化学平衡的移动,故A正确;
B.对于气体总体积反应前后不变的可逆反应(如I2+H2?2HI)来说,无论是否建立平衡,其总物质的量即压强都不会发生变化;对于气体总体积反应前后不等的可逆反应(如2SO2+O2?2SO3)来说,建立化学平衡状态时,总物质的量要与初始时的总物质的量不等,故压强要改变,故B错误;
C.化学反应速率发生改变,未必能说明化学平衡发生了移动,当正反应速率与逆反应速率仍然相等时,化学平衡不会发生移动;当正反应速率与逆反应速率不相等时,化学平衡就会发生移动,故C错误;
D.催化剂只能同等程度地改变正反应速率和逆反应速率,当一个可逆反应建立化学平衡状态后,加入催化剂,正反应速率仍然等于逆反应速率,化学平衡不会发生移动,故D错误;
故选A.
B.对于气体总体积反应前后不变的可逆反应(如I2+H2?2HI)来说,无论是否建立平衡,其总物质的量即压强都不会发生变化;对于气体总体积反应前后不等的可逆反应(如2SO2+O2?2SO3)来说,建立化学平衡状态时,总物质的量要与初始时的总物质的量不等,故压强要改变,故B错误;
C.化学反应速率发生改变,未必能说明化学平衡发生了移动,当正反应速率与逆反应速率仍然相等时,化学平衡不会发生移动;当正反应速率与逆反应速率不相等时,化学平衡就会发生移动,故C错误;
D.催化剂只能同等程度地改变正反应速率和逆反应速率,当一个可逆反应建立化学平衡状态后,加入催化剂,正反应速率仍然等于逆反应速率,化学平衡不会发生移动,故D错误;
故选A.
点评:本题要求要能灵活运用影响化学平衡的因素来分思考问题,是对基础知识灵活运用的考查,要求学习时一定要记住并能深刻理解,题目较简单.

练习册系列答案
相关题目
用惰性电极电解100mL CuSO4溶液一段时间后,可以通过添加0.1mol Cu(OH)2将溶液的量与浓度完全复原,则电解时电路中通过的电子为 ( )
| A、0.1mol |
| B、0.2mol |
| C、0.4mol |
| D、0.8mol 1 |
用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按如图步骤分开五种离子,则溶液①、②、③、④是( )


| A、①NaCl ②NaOH ③NH3?H2O ④H2SO4 |
| B、①NaCl ②NH3?H2O ③NaOH ④H2SO4 |
| C、①H2SO4 ②NH3?H2O ③NaOH ④NaCl |
| D、①H2SO4 ②NaOH ③NH3?H2O ④NaCl |
用电解水的方法分析水的组成时,需要加入一些电解质以增强水的导电性,不宜加入的物质是( )
| A、Na2SO4 |
| B、NaNO3 |
| C、KOH |
| D、Cu SO4 |
下列各组物质不属于同分异构体的是( )
| A、葡萄糖和果糖 |
| B、淀粉和纤维素 |
| C、蔗糖和麦芽糖 |
| D、正戊烷和新戊烷 |
在容积相同的甲、乙两个密闭容器中,均分别充入2mol SO2和1mol O2,发生反应:2SO2+O2?2SO3,在相同温度下,若甲容器始终保持体积不变,乙容器始终保持压强不变,达平衡时测得甲容器中SO2的转化率为25%,则乙容器中SO2的转化率( )
| A、25% | B、小于25% |
| C、大于25% | D、无法确定 |
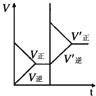
 在温度相同,压强分别为P1和P2的条件下,2A(g)+B(s)?nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如图所示,下面结论正确的是( )
在温度相同,压强分别为P1和P2的条件下,2A(g)+B(s)?nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如图所示,下面结论正确的是( )| A、P1>P2,n<3 |
| B、P1<P2,n>2 |
| C、P1>P2,n>3 |
| D、P1<P2,n<2 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A、生成42.0LN2(标准状况) |
| B、转移电子的物质的量为1.25mol |
| C、有0.250molKNO3被氧化 |
| D、被氧化的N原子的物质的量为1.875mol |