题目内容
在容积相同的甲、乙两个密闭容器中,均分别充入2mol SO2和1mol O2,发生反应:2SO2+O2?2SO3,在相同温度下,若甲容器始终保持体积不变,乙容器始终保持压强不变,达平衡时测得甲容器中SO2的转化率为25%,则乙容器中SO2的转化率( )
| A、25% | B、小于25% |
| C、大于25% | D、无法确定 |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:在相同温度下发生反应2SO2+O2?2SO3,该反应为气体物质的量减小的反应,若甲容器保持体积不变,乙容器保持压强不变,则随着反应的进行,甲的压强逐渐减小,达平衡时,乙容器压强大于甲容器压强,根据压强对平衡移动的影响分析.
解答:
解:2SO2+O2?2SO3反应为气体物质的量减小的反应,
若甲容器保持体积不变,乙容器保持压强不变,则随着反应的进行,甲的压强逐渐减小,乙容器压强大于甲容器压强,增大压强,平衡向正反应方向移动,当甲中的SO2的转化率为25%时,则乙容器中SO2的转化率应是大于25%,
故选:C.
若甲容器保持体积不变,乙容器保持压强不变,则随着反应的进行,甲的压强逐渐减小,乙容器压强大于甲容器压强,增大压强,平衡向正反应方向移动,当甲中的SO2的转化率为25%时,则乙容器中SO2的转化率应是大于25%,
故选:C.
点评:本题考查化学平衡的影响因素,题目难度中等,注意根据反应方程式的特点把握压强对平衡移动的影响.

练习册系列答案
相关题目
下列有关离子的检验方法一定正确的是( )
| A、向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含SO42- |
| B、用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+ |
| C、向某溶液中加足量稀HCl,产生的气体能使澄清石灰水变浑浊则说明溶液中一定含CO32- |
| D、某溶液中加NaOH溶液,加热产生的气体能使湿润红色石蕊试纸变蓝说明溶液中一定含NH4+ |
可确认发生了化学平衡移动的是( )
| A、由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 |
| B、有气态物质参加的可逆反应达到平衡后,改变了压强 |
| C、化学反应速率发生了改变 |
| D、可逆反应达到平衡后,使用催化剂 |
某兴趣小组为探究外界条件对可逆反应A(g)+B(g)═C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ.然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ.
针对上述系列实验,下列结论中错误的是( )
| A | B | C | |
| Ⅰ | 0.050mol?L-1 | 0.050mol?L-1 | 0.050mol?L-1 |
| Ⅱ | 0.070mol?L-1 | 0.070mol?L-1 | 0.098mol?L-1 |
| Ⅲ | 0.060mol?L-1 | 0.060mol?L-1 | 0.040mol?L-1 |
| Ⅳ | 0.080mol?L-1 | 0.080mol?L-1 | 0.12mol?L-1 |
| A、由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol-1?L |
| B、Ⅱ可能是通过增大C的浓度实现的 |
| C、若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应 |
| D、第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现 |
下列说法正确的是( )
| A、CH4和Cl2以物质的量之比为1:1混合,光照下只生成CH3Cl和HCl |
| B、分子式为C3H5Cl3的同分异构体共有(不考虑立体异构)5种 |
C、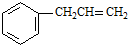 分子中所有原子可以处在同一平面上 分子中所有原子可以处在同一平面上 |
D、单体CH2═CHCH3和CH2═CH2可以通过加聚反应合成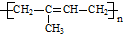 |
为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入( )
①饱和NaHCO3溶液;无水CaCl2固体
②饱和NaHCO3溶液;浓硫酸
③浓硫酸;饱和NaHCO3溶液
④饱和Na2CO3溶液;稀硫酸.
①饱和NaHCO3溶液;无水CaCl2固体
②饱和NaHCO3溶液;浓硫酸
③浓硫酸;饱和NaHCO3溶液
④饱和Na2CO3溶液;稀硫酸.
| A、①② | B、③④ | C、①③ | D、②④ |
化学与生活密切相关,下列说法正确的是( )
| A、二氧化硫广泛用于食品的漂白 |
| B、生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其单体的分子式为C8H10 |
| C、合成纤维,人造纤维及碳纤维都属于有机高分子材料 |
| D、先通入氯气,再加入硫酸亚铁处理水,能达到消毒杀菌和除去悬浮杂质的目的 |
