题目内容
将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)
(1)生成沉淀的质量刚好最大时,反应的离子方程式为: .
(2)原混合物中Ca(OH)2的质量为 g.(请写出计算过程)
(3)当沉淀达到最大时,再通入CO2,到沉淀恰好溶解时,过程消耗CO2的体积为 mL.
(1)生成沉淀的质量刚好最大时,反应的离子方程式为:
(2)原混合物中Ca(OH)2的质量为
(3)当沉淀达到最大时,再通入CO2,到沉淀恰好溶解时,过程消耗CO2的体积为
考点:有关混合物反应的计算,化学方程式的有关计算
专题:计算题
分析:KOH和Ca(OH)2混合物溶于水中形成稀溶液,通入足量的CO2气体所发生的离子反应有:
①2OH-+CO2=CO32-,②CO32-+Ca2+=CaCO3↓③CaCO3+CO2+H2O=Ca(HCO3)2,
根据以上反应,可把反应分为四个阶段:
(1)二氧化碳会先和氢氧化钙反应生成碳酸钙沉淀,方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
(2)二氧化碳会继续和氢氧化钾反应,方程式为2K0H+CO2=K2CO3+H2O,
(3)二氧化碳会继续和碳酸钾反应,方程式为K2CO3+CO2+H2O=2KHCO3,
(4)二氧化碳会继续和碳酸钙反应生成碳酸氢钙,方程式为CaCO3+CO2+H2O=Ca(HCO3)2,
据消耗CO2的体积为224mL结合化学方程式计算.
①2OH-+CO2=CO32-,②CO32-+Ca2+=CaCO3↓③CaCO3+CO2+H2O=Ca(HCO3)2,
根据以上反应,可把反应分为四个阶段:
(1)二氧化碳会先和氢氧化钙反应生成碳酸钙沉淀,方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
(2)二氧化碳会继续和氢氧化钾反应,方程式为2K0H+CO2=K2CO3+H2O,
(3)二氧化碳会继续和碳酸钾反应,方程式为K2CO3+CO2+H2O=2KHCO3,
(4)二氧化碳会继续和碳酸钙反应生成碳酸氢钙,方程式为CaCO3+CO2+H2O=Ca(HCO3)2,
据消耗CO2的体积为224mL结合化学方程式计算.
解答:
解:(1)二氧化碳会先和氢氧化钙反应生成碳酸钙沉淀,方程式为CO2+Ca(OH)2=CaCO3↓+H2O,离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O;
(2)根据反应方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
设氢氧化钙的物质的量为x,那么x应该等于二氧化碳的量,即
=0.01mol,
所以氢氧化钙的质量为0.01mol×74g/mol=0.74g,
故答案为:0.74;
(3)1.86gKOH和Ca(OH)2混合物中,n(KOH)=
=0.02mol,
沉淀恰好溶解时,所反应的反应依次有:
①2K0H+CO2 =K2CO3+H2O
0.02mol 0.01mol 0.01mol
②K2CO3 +CO2 +H2O=2KHCO3,
0.01mol 0.01mol
③CaCO3 +CO2 +H2O=Ca(HCO3)2
0.01mol 0.01mol
沉淀恰好溶解时,消耗CO2的物质的量为0.01mol+0.01mol+0.01mol=0.03mol,
体积为:0.03mol×22.4L/mol=0.672L,即672ml,
故答案为:672.
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O;
(2)根据反应方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
设氢氧化钙的物质的量为x,那么x应该等于二氧化碳的量,即
| 0.224L |
| 22.4L/mol |
所以氢氧化钙的质量为0.01mol×74g/mol=0.74g,
故答案为:0.74;
(3)1.86gKOH和Ca(OH)2混合物中,n(KOH)=
| 1.86g-0.74g |
| 56g/mol |
沉淀恰好溶解时,所反应的反应依次有:
①2K0H+CO2 =K2CO3+H2O
0.02mol 0.01mol 0.01mol
②K2CO3 +CO2 +H2O=2KHCO3,
0.01mol 0.01mol
③CaCO3 +CO2 +H2O=Ca(HCO3)2
0.01mol 0.01mol
沉淀恰好溶解时,消耗CO2的物质的量为0.01mol+0.01mol+0.01mol=0.03mol,
体积为:0.03mol×22.4L/mol=0.672L,即672ml,
故答案为:672.
点评:本题考查混合物的计算,题目难度中等,注各阶段的反应物的物质的量以及发生的化学反应.

练习册系列答案
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
可用如图所示装置制取、干燥、收集并吸收多余气体的是( )
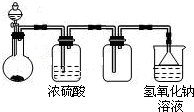

| A、浓氨水与氧化钙固体反应制氨气 |
| B、稀硫酸与硫化亚铁固体反应制硫化氢 |
| C、浓盐酸与次氯酸钙固体反应制氯气 |
| D、饱和食盐水与电石反应制乙炔 |
下列叙述不正确的是( )
| A、除去NO中混有的NO2:用水洗气 |
| B、Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
| C、加入新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 |
| D、向某溶液中先加入硝酸,后再加入BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42- |
下列除质或鉴别方法可行的是( )
| A、用过量氨水除去Al3+溶液中的少量Fe3+ |
| B、将混合气体通过灼热的铜网除去N2中的少量O2 |
| C、向某溶液中加HCl酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定含有SO42- |
| D、向澄清石灰水中通入少量气体产生沉淀,过量时沉淀溶解,说明该气体一定是CO2 |
温度为T℃时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前50 s的平均速率为v(PCl3)=0.0032mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol?L-1,则反应的△H<0 |
| C、相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆) |
| D、相同温度下,起始时向容器中充入2.0molPCl5、2.0molCl2,达到平衡时,PCl5的转化率大于20% |
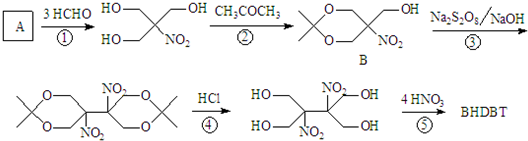
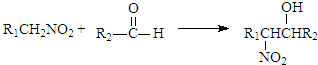 (将R1CH2NO2中硝基换为醛基,也能发生类似反应)
(将R1CH2NO2中硝基换为醛基,也能发生类似反应)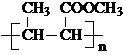 ),合成过程中无机试剂任选,合成路线流程图示例如下:CH3CH2OH
),合成过程中无机试剂任选,合成路线流程图示例如下:CH3CH2OH