题目内容
(1)用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作.根据图1对应的操作,指出其不规范之处
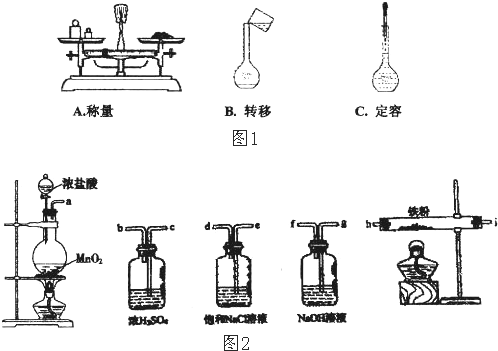
A.称量: B.转移: C.定容:
(2)将X气体通入BaC12溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y可能是: (填选项字母代号)
(3)如图2所示仪器可用于实验室制备少量极易吸水的无水FeC13.
①仪器连接的正确顺序是:
a→ → → → →g(图中装置如果需要可以重复使用)
②饱和NaC1溶液的作用:
(4)SO2可用于制硫酸.已知25℃、101kPa时:
①2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol;
②H2O(g)=H2O(l
_ △H1=-44kJ/mol;
③2SO2(g)+O2(g)+2H2O (g)=2H2SO4(l
_ △H1=-545kJ/mol;
则SO3(g)与H2O(1)反应的热化学方程式是: .

A.称量:
(2)将X气体通入BaC12溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y可能是:
| 选项 | X | Y |
| a | SO2 | NO2 |
| b | C12 | CO2 |
| c | NH3 | CO2 |
| d | SO2 | H2S |
①仪器连接的正确顺序是:
a→
②饱和NaC1溶液的作用:
(4)SO2可用于制硫酸.已知25℃、101kPa时:
①2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol;
②H2O(g)=H2O(l
| ) |
③2SO2(g)+O2(g)+2H2O (g)=2H2SO4(l
| ) |
则SO3(g)与H2O(1)反应的热化学方程式是:
考点:配制一定物质的量浓度的溶液,用盖斯定律进行有关反应热的计算,氯气的实验室制法
专题:化学反应中的能量变化,物质的量浓度和溶解度专题,卤族元素
分析:(1)A.使用托盘天平称量药品时,应该遵循左物右码原则,位置不能颠倒;
B.转移:转移冷却后的溶液时,需要使用玻璃棒引流;
C.定容时,胶头滴管不能伸入到容量瓶中;
(2)a、二氧化氮溶于水生成硝酸,硝酸能够将二氧化硫氧化成硫酸,硫酸与钡离子反应生成硫酸钡沉淀;
b、氯气不和BaCl2溶液反应,通入二氧化碳不能反应,无沉淀生成;
c、氨气显碱性,能和二氧化碳反应生成碳酸铵,碳酸根离子结合钡离子生成碳酸钡沉淀;
d、硫化氢和二氧化硫反应生成硫单质;
(3)①根据先制取氯气、除去氯气中的氯化氢杂质、干燥氯气、氯气与铁反应、干燥装置、完全吸收装置的顺序进行解答;
②制取的氯气中混有杂质氯化氢,需要用饱和氯化钠溶液除去杂质氯化氢;
(4)利用盖斯定律,将热化学方程式进行运算,写出SO3(g)与H2O(1)反应的热化学方程式.
B.转移:转移冷却后的溶液时,需要使用玻璃棒引流;
C.定容时,胶头滴管不能伸入到容量瓶中;
(2)a、二氧化氮溶于水生成硝酸,硝酸能够将二氧化硫氧化成硫酸,硫酸与钡离子反应生成硫酸钡沉淀;
b、氯气不和BaCl2溶液反应,通入二氧化碳不能反应,无沉淀生成;
c、氨气显碱性,能和二氧化碳反应生成碳酸铵,碳酸根离子结合钡离子生成碳酸钡沉淀;
d、硫化氢和二氧化硫反应生成硫单质;
(3)①根据先制取氯气、除去氯气中的氯化氢杂质、干燥氯气、氯气与铁反应、干燥装置、完全吸收装置的顺序进行解答;
②制取的氯气中混有杂质氯化氢,需要用饱和氯化钠溶液除去杂质氯化氢;
(4)利用盖斯定律,将热化学方程式进行运算,写出SO3(g)与H2O(1)反应的热化学方程式.
解答:
解:(1)A.称量:用天平称量药品,药品不能直接放在托盘内,天平称量应遵循“左物右码”,故答案为:药品与砝码放反了,应作药品右砝码;
B.转移溶液时,应用玻璃棒引流,防止溶液洒落,故答案为:未用玻璃棒引流;
C.定容:胶头滴管不能深入容量瓶内,应在容量瓶正上方,悬空滴加,故答案为:胶头滴管不能伸入容量瓶内;
(2)a、二氧化硫不与氯化钡溶液反应,当通入二氧化氮后,二氧化氮与与水反应生成硝酸,硝酸能够将二氧化硫氧化成硫酸,硫酸与氯化钡反应:H2SO4+BaCl2═BaSO4↓+2HCl,生成硫酸钡沉淀,故a正确;
b、氯气不与BaCl2溶液反应,通入二氧化碳也不反应,无沉淀生成,故b错误;
c、氨气与氯化钡溶液不反应,通入二氧化碳后发生反应:2NH3+H2O+CO2═(NH4)2C03、(NH4)2C03+BaCl2═BaCO3↓+2NH4Cl,生成了碳酸钡沉淀,故c正确;
d、二氧化硫与氯化钡溶液不反应,通入硫化氢后,硫化氢与二氧化硫发生反应:2H2S+SO2═3S↓+H2O,有沉淀生成,故d正确;
故答案为:acd;
(3)①制取氯化铁需要先制取氯气,所以仪器连接从a开始、然后连接e(除去氯气中杂质氯化氢的装置)、d连接干燥氯气的装置的导管c、干燥后的氯气从导管b通过导管h进入反应装置、反应装置右边的导管还需要连接干燥装置,即i连接c、最后需要用氢氧化钠溶液进行尾气吸收,故b连接g,正确的连接顺序为:a→e→d→c→b→h→i→c→b→g,
故答案为:e;d;c;b;h;i;c;b;
②氯化氢具有挥发性,所以制取的氯气中会混有氯化氢,饱和氯化钠溶液的作用是吸收氯气中的氯化氢,
故答案为:吸收氯气中的氯化氢气体;
(4)①2SO2(g)+O2(g)?2SO3(g)△H1=一197kJ/mol
②2H2O (g)=2H2O(1)△H2=-44kJ/mol
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol
利用盖斯定律:(③-①-②)÷2 可得:SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ/mol.
B.转移溶液时,应用玻璃棒引流,防止溶液洒落,故答案为:未用玻璃棒引流;
C.定容:胶头滴管不能深入容量瓶内,应在容量瓶正上方,悬空滴加,故答案为:胶头滴管不能伸入容量瓶内;
(2)a、二氧化硫不与氯化钡溶液反应,当通入二氧化氮后,二氧化氮与与水反应生成硝酸,硝酸能够将二氧化硫氧化成硫酸,硫酸与氯化钡反应:H2SO4+BaCl2═BaSO4↓+2HCl,生成硫酸钡沉淀,故a正确;
b、氯气不与BaCl2溶液反应,通入二氧化碳也不反应,无沉淀生成,故b错误;
c、氨气与氯化钡溶液不反应,通入二氧化碳后发生反应:2NH3+H2O+CO2═(NH4)2C03、(NH4)2C03+BaCl2═BaCO3↓+2NH4Cl,生成了碳酸钡沉淀,故c正确;
d、二氧化硫与氯化钡溶液不反应,通入硫化氢后,硫化氢与二氧化硫发生反应:2H2S+SO2═3S↓+H2O,有沉淀生成,故d正确;
故答案为:acd;
(3)①制取氯化铁需要先制取氯气,所以仪器连接从a开始、然后连接e(除去氯气中杂质氯化氢的装置)、d连接干燥氯气的装置的导管c、干燥后的氯气从导管b通过导管h进入反应装置、反应装置右边的导管还需要连接干燥装置,即i连接c、最后需要用氢氧化钠溶液进行尾气吸收,故b连接g,正确的连接顺序为:a→e→d→c→b→h→i→c→b→g,
故答案为:e;d;c;b;h;i;c;b;
②氯化氢具有挥发性,所以制取的氯气中会混有氯化氢,饱和氯化钠溶液的作用是吸收氯气中的氯化氢,
故答案为:吸收氯气中的氯化氢气体;
(4)①2SO2(g)+O2(g)?2SO3(g)△H1=一197kJ/mol
②2H2O (g)=2H2O(1)△H2=-44kJ/mol
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol
利用盖斯定律:(③-①-②)÷2 可得:SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ/mol.
点评:本题考查了配制一定物质的量浓度的溶液方法、用盖斯定律进行反应热的计算、氯化铁的制备等知识,题目难度稍大,试题涉及的知识点较大,作用掌握配制一定浓度的溶液方法,能够根据盖斯定律书写热化学方程式.

练习册系列答案
相关题目
随着社会的发展,人们日益重视环境问题,下列做法或说法不正确的是( )
| A、将煤液化或气化,获得清洁燃料 |
| B、提倡重拎布袋子、重提菜篮子,重复使用耐用型购物袋 |
| C、对垃圾进行无害化、资源化处理 |
| D、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 |
已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g 液态水时放出的热量是( )
| A、26.0kJ |
| B、51.9kJ |
| C、155.8kJ |
| D、467.3kJ |
下列实验操作中错误的是( )
| A、碘水中萃取碘时,往分液漏斗中先后加入碘水和酒精,充分振荡静置后分液 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、分液操作时,应先从分液漏斗的下口放出下层液体,再从上口倒出上层液体 |
| D、蒸发时,当蒸发皿中的水只残留少许时,停止加热,利用余热将剩余水分蒸干 |
北京奥运会“祥云”火炬使用的燃料为丙烷.下列关于丙烷的说法正确的是( )
| A、1mol丙烷完全燃烧需4mol氧气 |
| B、与丁烷互为同分异构体 |
| C、能使酸性高锰酸钾溶液褪色 |
| D、分子式为C3H8 |


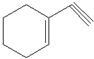 (1)某有机化合物分子结构式如图采取sp2杂化的C原子有
(1)某有机化合物分子结构式如图采取sp2杂化的C原子有