题目内容
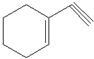 (1)某有机化合物分子结构式如图采取sp2杂化的C原子有
(1)某有机化合物分子结构式如图采取sp2杂化的C原子有(2)试比较含氧酸酸性的强弱(填”>”,”<”或”=”)HClO4
(3)沸点比较(填”>”,”<”或”=”):邻羟基苯甲醛
(4)晶格能比较(填”>”,”<”或”=”):CaO
考点:原子轨道杂化方式及杂化类型判断,元素周期律的作用,常见有机化合物的结构
专题:原子组成与结构专题,元素周期律与元素周期表专题
分析:(1)根据有机物中碳原子的成键类型判断;
(2)判断含氧酸(含有氧元素的酸)酸性强弱的一条经验规律是:含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强;
(3)根据氢键对物理性质的影响分析;
(4)离子晶体中,离子所带电荷多的晶格能大,熔点高.
(2)判断含氧酸(含有氧元素的酸)酸性强弱的一条经验规律是:含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强;
(3)根据氢键对物理性质的影响分析;
(4)离子晶体中,离子所带电荷多的晶格能大,熔点高.
解答:
解:(1)有机物中C原子为单键时为sp3杂化,C原子为双键时为sp2杂化,C原子为三键时为sp杂化,分子中含有一个C=C,则采取sp2杂化的C原子有2个;
故答案为:2;
(2)含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强,所以含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强,酸性由强到弱:HClO4>HClO3;
故答案为:>;
(3)邻羟基苯甲醛能形成分子内氢键,对羟基苯甲醛能形成分子间氢键,所以邻羟基苯甲醛的熔点低于对羟基苯甲醛;
故答案为:<;
(4)离子晶体中,离子所带电荷多的晶格能大,熔点高,所以熔点CaO>KF;
故答案为:>.
故答案为:2;
(2)含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强,所以含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强,酸性由强到弱:HClO4>HClO3;
故答案为:>;
(3)邻羟基苯甲醛能形成分子内氢键,对羟基苯甲醛能形成分子间氢键,所以邻羟基苯甲醛的熔点低于对羟基苯甲醛;
故答案为:<;
(4)离子晶体中,离子所带电荷多的晶格能大,熔点高,所以熔点CaO>KF;
故答案为:>.
点评:本题考查了杂化轨道、氢键、离子晶体熔点的比较等,难度中等,注意基础知识的掌握与规律的总结.

练习册系列答案
相关题目
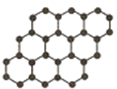 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A、石墨烯与石墨互为同位素 |
| B、12g石墨烯中含有3NA个C-C键 |
| C、石墨烯是一种有机物 |
| D、石墨烯中的碳原子间以共价键结合 |
 工业上可用如图原理来制备高铁酸钠(Na2FeO4),下列说法正确的是( )
工业上可用如图原理来制备高铁酸钠(Na2FeO4),下列说法正确的是( )| A、该装置实现了主要的能量转化:化学能→电能 |
| B、Ni电极反应:4OH--4e-=2H2O+O2↑ |
| C、装置右侧的OH-通过隔膜移向左侧 |
| D、一段时间后,充分混合两端液体,溶液pH值会增小 |