题目内容
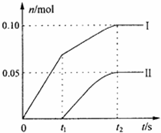
4.某石灰乳中缓缓通入氯气,随着反应的进行,温度升高开始产生Ca(ClO3)2.ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为右图(不考虑氯气和水的反应).(1)所取石灰乳中含有Ca(OH)2的物质的量为0.25mol;
(2)另取一份含0.5mol Ca(OH)2的石灰乳,缓缓通入足量氯气,反应后测得产物中Cl-的物质的量为0.7mol,则参加反应的氯气在标准状况下的体积为11.2L.
分析 (1)当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,根据氧化还原反应中得失电子数相等计算氯离子的物质的量,然后根据含氯化合物中钙离子和阴离子的个数比计算氢氧化钙的物质的量;
(2)另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.7mol,依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,结合b计算得到氢氧化钙物质的量计算氯元素物质的量,依据氧化还原反应电子守恒,生成产物中氯元素守恒列式计算.
解答 解:(1)当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图2中曲线I表示离子ClO-的物质的量随反应时间变化的关系;
设氯离子的物质的量为n,则n×1=0.10mol×1+0.05mol×5=0.35mol,含氯元素的物质的量=0.35mol+0.1mol+0.05mol=0.5mol,氯化钙、次氯酸钙、氯酸钙中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为0.25mol,
故答案为:0.25;
(2)另取一份含0.5mol Ca(OH)2的石灰乳,反应后生成产物为CaCl2、Ca(ClO)2、Ca(ClO3)2,由钙守恒可知应为0.5mol,反应后测得产物中Cl-的物质的量为0.7mol,则CaCl2为0.35mol,Ca(ClO)2、Ca(ClO3)2共0.15mol,
设Ca(ClO)2为xmol,Ca(ClO3)2为ymol,
则有$\left\{\begin{array}{l}{x+y=0.15(钙守恒)}\\{2x+5y×2=0.7(电子守恒)}\end{array}\right.$,x=0.1,y=0.05,
则n(Cl)=0.7mol+0.1mol×2+0.05mol×2=1mol,
n(Cl2)=0.5mol,
V(Cl2)=0.5mol×22.4L/mol=11.2L,
故答案为:11.2.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析、计算能力的考查,本题注意从守恒的角度解答,把握质量守恒和电子守恒的运用,难度中等.

 发散思维新课堂系列答案
发散思维新课堂系列答案| 选项 | 实验目的 | 仪器 |
| A | 除去氯化钠溶液中的泥沙 | 漏斗(带滤纸)、烧杯、玻璃棒 |
| B | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
| C | 用0.10mol•L-1的盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
| D | 用MnO2和浓盐酸制取干燥、纯净的Cl2 | 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网 |
| A. | A | B. | B | C. | C | D. | D |
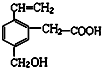
| A. | 可与NaOH溶液反应 | B. | 可发生酯化反应 | ||
| C. | 可使酸性KMnO4溶液褪色 | D. | 可在碱性条件下水解 |
| A. | 氯化镁溶液中加氨水:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+ | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 稀硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 碳酸钙溶于醋酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O |
| A. | 乙烯能使酸性高锰酸钾溶液褪色,发生了加成反应 | |
| B. | 苯可以使溴水褪色,发生了取代反应 | |
| C. | 乙醛在一定条件下与氢气反应生成乙醇,发生了氧化反应 | |
| D. | 苯在一定条件下能与浓硝酸反应得到硝基苯,发生了取代反应 |
(1)根据下列实验步骤和现象,推断实验结论:
| 实验步骤与实验现象 | 实验结论 |
| Ⅰ.观察溶液:无色透明 | ①原溶液中一定不含的离子是Cu2+、MnO4-、Fe2+ |
| Ⅱ.取适量该溶液,加入过量的硝酸,有气体生成,并得到无色溶液 | ②原溶液中一定不含的离子是Mg2+、Ag+、Ba2+、Al3+、I-、SiO32-,一定含有的离子是CO32-、K+ |
| Ⅲ.在Ⅱ所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀A | ③原溶液中还一定含有的离子是AlO2-,生成沉淀A的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
| Ⅳ.在Ⅲ所得溶液中再逐滴加入氢氧化钡溶液至过量,加热也有气体生成,同时析出白色沉淀B | ④白色沉淀B中一定含有BaCO3,可能含有BaSO4 |
 (3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示.
(3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示.Y可能为HCl或HNO3,B的组成为BaCO3、BaSO4且$\frac{n(BaS{O}_{4})}{n(BaC{O}_{3})}$=$\frac{2}{3}$.
(4)已知氧氧化铝电离出H+比碳酸氢钠电离出H+更难.根据上述推断,取少量原溶液于试管中,向试管中滴加少量硫酸氢钠稀溶液至过量,按先后顺序可以观察到的现象有先是生成白色沉淀,然后产生气泡,最后沉淀溶解.写出最后发生反应的离子方程式:Al(OH)3+3H+=Al3++3H2O.
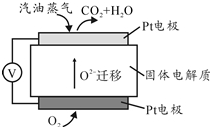 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$