题目内容
14.仅用下表提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的是( )| 选项 | 实验目的 | 仪器 |
| A | 除去氯化钠溶液中的泥沙 | 漏斗(带滤纸)、烧杯、玻璃棒 |
| B | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
| C | 用0.10mol•L-1的盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
| D | 用MnO2和浓盐酸制取干燥、纯净的Cl2 | 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.除去氢氧化铝胶体中的泥沙,需要通过过滤操作完成,根据过滤操作方法分析;
B.从食盐水中获得NaCl晶体,需要通过蒸发操作完成,根据蒸发操作步骤分析使用的仪器;
C.根据中和滴定的操作步骤判断使用仪器;
D.用MnO2和浓盐酸制取干燥、纯净的Cl2,需要除去氯气中的氯化氢杂,还需要干燥,据此判断使用仪器.
解答 解:A.除去氢氧化铝胶体中的泥沙,需过滤,过滤是把不溶于液体的固体与液体分离的一种方法,过滤时需用锥形漏斗(带滤纸)制作过滤器,需用玻璃棒引流,需用烧杯承接过滤液,过滤操作的装置由漏斗(带滤纸)、烧杯、玻璃棒,能实现相应实验目的,故A不选;
B.从食盐水中获得NaCl晶体的步骤,进行蒸发时需用到酒精灯来加热,需用蒸发皿、泥三角,要使用玻璃棒不断搅拌,以防液体溅出,蒸发完毕后移动很热的蒸发皿的用坩埚钳,仅用提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的,故B选;
C.用0.1000mol•L-1的盐酸测定未知浓度的NaOH溶液浓度,取0.1000mol•L-1的盐酸,需酸式滴定管,取未知浓度的NaOH溶液需碱式滴定管,放入锥形瓶中,用胶头滴管滴加指示剂,能实现相应实验目的,故C不选;
D.浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,制取氯气需用圆底烧瓶、石棉网、分液漏斗、酒精灯、导管,制取的氯气中混有氯化氢气体和水蒸气,所以需洗气瓶装饱和氯化钠除去氯气中的氯化氢;所以需洗气瓶装浓硫酸除去氯气中的水蒸气,用集气瓶收集纯净气体,能实现相应实验目的,故D不选;
故选B.
点评 本题主要考查了化学实验方案的评价,题目难度不大,解答本题要从各种操作的过程方面进行分析、判断,从而得出正确的结论,试题侧重考查学生的分析能力及化学实验能力.

练习册系列答案
相关题目
4.下列有关烷烃的叙述中,正确的是( )
①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
③分子通式为CnH2n+2的不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色.
①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
③分子通式为CnH2n+2的不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色.
| A. | ①③⑤ | B. | ①④ | C. | ②③ | D. | ①②④ |
5.工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置.实验时按如下步骤操作:
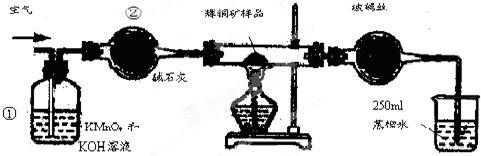
实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数.
A.连接全部仪器,使其成为如图装置,并检查装置的气密性.
B.称取研细的辉铜矿样品1.000g.
C.将称量好的样品小心地放入硬质玻璃管中.
D.以每分钟1L的速率鼓入空气.
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu.
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点.按上述操作方法重复滴定2-3次.
试回答下列问题:
(1)装置①的作用是除去空气中的还原性气体与酸性气体;装置②的作用是干燥空气.
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O或2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是80%.
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是在KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低(写一种即可).
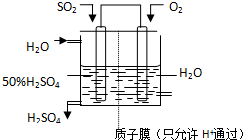
(5)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式SO2-2e-+2H2O=SO42-+4H+.

实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数.
A.连接全部仪器,使其成为如图装置,并检查装置的气密性.
B.称取研细的辉铜矿样品1.000g.
C.将称量好的样品小心地放入硬质玻璃管中.
D.以每分钟1L的速率鼓入空气.
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu.
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点.按上述操作方法重复滴定2-3次.
试回答下列问题:
(1)装置①的作用是除去空气中的还原性气体与酸性气体;装置②的作用是干燥空气.
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O或2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是80%.
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式SO2-2e-+2H2O=SO42-+4H+.

6.下列有机物命名正确的是( )
| A. |  1,3,4-三甲苯 | B. |  2-甲基-2-氯丙烷 | C. |  2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 |
3.下列物质的性质比较,正确的是( )
| A. | 酸性:H2CO3>HNO3 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:Si>P | D. | 气态氢化物稳定性:H2O>H2S |
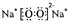 ,该物质含有的化学键的类型是离子键、非极性共价键 .
,该物质含有的化学键的类型是离子键、非极性共价键 .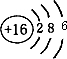 .
.