题目内容
16.24.5gH2SO4的物质的量为0.25mol,其中含0.25mol硫原子,含0.5g氢原子,含NA个氧原子,其水溶液中含有0.5molH+和0.25molSO42-.分析 结合n=$\frac{m}{M}$及分子构成、H2SO4═2H++SO42-来解答.
解答 解:24.5gH2SO4的物质的量为$\frac{24.5g}{98g/mol}$=0.25mol,其中含硫原子为0.25mol,含氢原子的质量为0.25mol×2×1g/mol=0.5g,含氧原子个数为0.25mol×4×NA=NA,由H2SO4═2H++SO42-可知其水溶液中含有0.5molH+和0.25molSO42-.
故答案为:0.25mol;0.25;0.5;NA;0.5;0.25.
点评 本题考查物质的量的计算,为高频考点,把握质量与物质的量的关系、分子构成为解答的关键,侧重分析与计算能力的考查,注意物质组成及构成的判断,题目难度不大.

练习册系列答案
相关题目
6.下列有机物命名正确的是( )
| A. |  1,3,4-三甲苯 | B. |  2-甲基-2-氯丙烷 | C. |  2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 |
7.已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平. 现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
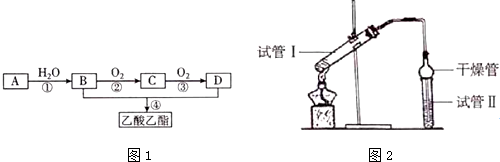
(1)有机物D中官能团的名称为羧基,①、④的反应类型分别为加成反应、酯化反应或取代反应.
(2)反应④的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(3)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图2的装罝制备乙酸乙酯.
①与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:防倒吸.
②试管Ⅱ中加入的试剂是饱和Na2CO3溶液,其作用是:吸收乙酸和乙醇,降低乙酸乙酯的溶解度.
③为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用该装置进行了以下4 个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ,再测其中有机层的厚度,实验记录如下:
实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,则进行实验D时应加入2 mL6mol•L-1的盐酸.分析实验A和实验C的数据,可以推断出浓H2SO4的吸水(填“催化”或“吸水”)作用提高了乙酸乙酯的产率.
(4)乙醇在一定条件下可转化为有机物E,E的相对分子质里为74,其分子中碳、氢的质量分数分别为64.9%、13.5%,其余为氧.求E的化学式C原子个数=$\frac{74×64.9%}{12}$≈4、H原子个数=$\frac{74×13.5%}{1}$≈10,则O原子个数=$\frac{74-12×4-1×10}{16}$=1,则C、H、O原子个数之比=4:10:1,则E的化学式为C4H10O(需写出计算过程).

(1)有机物D中官能团的名称为羧基,①、④的反应类型分别为加成反应、酯化反应或取代反应.
(2)反应④的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(3)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图2的装罝制备乙酸乙酯.
①与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:防倒吸.
②试管Ⅱ中加入的试剂是饱和Na2CO3溶液,其作用是:吸收乙酸和乙醇,降低乙酸乙酯的溶解度.
③为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用该装置进行了以下4 个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ,再测其中有机层的厚度,实验记录如下:
| 实验编号 | 试管I中试剂 | 试管Ⅱ中有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、2mL 18mol•L-1浓硫酸 | 3.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL 乙醇、2mL 乙酸 2mL3mol•L-1H2SO4 | 0.6 |
| D | 3mL乙醇、2mL乙酸、盐酸 | 0.6 |
(4)乙醇在一定条件下可转化为有机物E,E的相对分子质里为74,其分子中碳、氢的质量分数分别为64.9%、13.5%,其余为氧.求E的化学式C原子个数=$\frac{74×64.9%}{12}$≈4、H原子个数=$\frac{74×13.5%}{1}$≈10,则O原子个数=$\frac{74-12×4-1×10}{16}$=1,则C、H、O原子个数之比=4:10:1,则E的化学式为C4H10O(需写出计算过程).
11.环保、安全的铝-空气电池的工作原理如图所示,下列有关叙述错误的是( )


| A. | NaCl的作用是增强溶液的导电性 | |
| B. | 正极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 电池工作过程中,电解质溶液的pH不断增大 | |
| D. | 用该电池作电源电解KI溶液制取1 mol KIO3,消耗铝电极的质量为54 g |
1.下列关于铝热剂的说法中,错误的是( )
| A. | 铝热剂的反应原理是利用铝的强还原剂 | |
| B. | 铝热剂的反应常用于冶炼难熔金属 | |
| C. | 铝热剂发生的铝热反应需要用镁带和氯酸钾引燃,所以是一个吸热反应 | |
| D. | 铝和所有金属物都可以组成铝热剂 |
8.已知2Al+2NaOH+2H2O→2NaAlO2+3H2↑.该反应中有关物理量的描述正确的是(NA表示阿伏伽德罗常数)( )
| A. | 每生成0.3molH2,被还原的水分子数目为0.6NA | |
| B. | 当有2.7gAl参加反应时,转移的电子数目为0.3NA | |
| C. | 每生成6.72L的H2,溶液中AlO2-的数目就增加0.2NA | |
| D. | 溶液中每增加0.1mol的AlO2-,Na+的数目就增加0.1NA |
17.下列A、B两种元素的原子序数,其中可以组成A2B型离子化合物的是( )
| A. | 6和8 | B. | 19和16 | C. | 17和12 | D. | 1和8 |