题目内容
20.下列各组热化学方程式中,△H1>△H2的是( )①C (s)+O2(g)═CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2
②S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H1 2H2(g)+O2(g)═2H2O(l)△H2
④CaO(s)+H2O(l)═Ca(OH)2(s)△H1CaCO3(s)═CaO(s)+CO2(g)△H2.
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①③ |
分析 ①碳不完全燃烧放热少,焓变包含负号比较大小;
②固体硫变为气态硫需要吸收热量;
③反应热的数值与物质的物质的量成正比;
④碳酸钙分解吸热焓变为正值,氧化钙和水反应是化合反应放热,焓变是负值.
解答 解:①碳不完全燃烧放热少,焓变包含负号比较大小,所以△H1<△H2,故①错误;
②S的燃烧是放热反应,所以△H<0,固体硫变为气态硫需要吸收热量,所以△H1>△H2,故②正确;
③H2的燃烧是放热反应,所以△H<0,反应热与物质的物质的量成正比,即2△H1=△H2,所以△H1>△H2,故③正确;
④碳酸钙分解吸热焓变为正值,氧化钙和水反应是化合反应放热,焓变是负值,所以△H1<△H2,故④错误;
故选:B.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.

练习册系列答案
相关题目
11.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
| A. | 高温、高压、催化剂条件下,足量N2与3 mol H2充分反应,共断裂H-H键3NA | |
| B. | 46 g Na与0.5 L 2 mol•L-1盐酸充分反应,转移电子数为2NA | |
| C. | 8.4 g固体NaHCO3中,含有阳离子0.2NA | |
| D. | 标准状况下,2.24 L CCl4含有的共价键数为0.4NA |
15.H、D、T、H+可以表示( )
| A. | 四种不同元素 | B. | 化学性质不同的氢原子 | ||
| C. | 氢元素的四种同位素 | D. | 氢元素的四种不同微粒 |
5.把100mL 0.3mol•L-1的硫酸溶液和50mL 0.6mol•L-1的硫酸溶液充分混合后,该溶液中H+的物质的量浓度为( )
| A. | 0.6 mol•L-1 | B. | 0.8 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
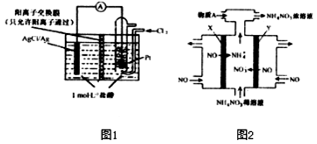 氧化还原反应与生产、生活、科技密切相关,请回答下列问题:
氧化还原反应与生产、生活、科技密切相关,请回答下列问题: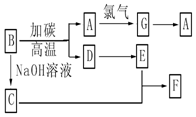 请回答下列问题:
请回答下列问题: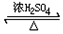 CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.
CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.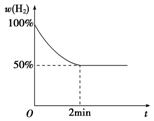 钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.