题目内容
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各离子不重复).
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为
(2)写出E溶液与过量的B溶液反应的离子方程式
(3)写出A溶液与E溶液反应的离子方程式 .
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为
(2)写出E溶液与过量的B溶液反应的离子方程式
(3)写出A溶液与E溶液反应的离子方程式
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:①A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为CO32-、OH-;又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+;
②A溶液与E溶液反应既有气体又有沉淀产生,即铝离子和碳酸根离子之间的双水解反应,碳酸钠和酸反应会产生二氧化碳气体;
③在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、氯化钠、硫酸铝、氢氧化钡反应生成沉淀,据此确定物质,并根据物质的性质来书写方程式.
②A溶液与E溶液反应既有气体又有沉淀产生,即铝离子和碳酸根离子之间的双水解反应,碳酸钠和酸反应会产生二氧化碳气体;
③在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、氯化钠、硫酸铝、氢氧化钡反应生成沉淀,据此确定物质,并根据物质的性质来书写方程式.
解答:
解:①A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为CO32-、OH-;又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+,
②Na2CO3和可溶性的铝盐反应的实质是:铝离子和碳酸根离子之间双水解反应,产物既有沉淀又有气体,所以A是碳酸钠,B是氢氧化钡,碳酸钠和酸反应会产生二氧化碳气体,故C中含有氢离子;
③在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、氯化钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,C是盐酸;
综上知道:A是碳酸钠,B是氢氧化钡,D是硝酸银,C是盐酸,E是硫酸铝.
(1)将C溶液(盐酸)逐滴加入等体积、等物质的量的浓度的A溶液碳酸钠中,反应后溶液中生成等物质的量的氯化钠和碳酸氢钠,溶液显示碱性,碳酸氢根离子的水解能力大于电离能力,各种离子浓度由大到小的顺序为c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),
故答案为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(2)硫酸铝溶液和过量的氢氧化钡溶液之间反应,则铝离子和硫酸根离子按照2:3的物质的量之比进行反应,其离子方程式为2A13++3SO42-+3Ba2++8OH=2A1O2-+3BaSO4↓+4H2O,故答案为:2A13++3SO42-+3Ba2++8OH=2A1O2-+3BaSO4↓+4H2O;
(3)碳酸钠中的碳酸根离子和硫酸铝中的铝离子之间会发生双水解反应:2A13++3CO32-+6 H2O=2A1(OH)3↓+3CO2↑,故答案为:2A13++3CO32-+6 H2O=2A1(OH)3↓+3CO2↑.
②Na2CO3和可溶性的铝盐反应的实质是:铝离子和碳酸根离子之间双水解反应,产物既有沉淀又有气体,所以A是碳酸钠,B是氢氧化钡,碳酸钠和酸反应会产生二氧化碳气体,故C中含有氢离子;
③在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、氯化钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,C是盐酸;
综上知道:A是碳酸钠,B是氢氧化钡,D是硝酸银,C是盐酸,E是硫酸铝.
(1)将C溶液(盐酸)逐滴加入等体积、等物质的量的浓度的A溶液碳酸钠中,反应后溶液中生成等物质的量的氯化钠和碳酸氢钠,溶液显示碱性,碳酸氢根离子的水解能力大于电离能力,各种离子浓度由大到小的顺序为c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),
故答案为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(2)硫酸铝溶液和过量的氢氧化钡溶液之间反应,则铝离子和硫酸根离子按照2:3的物质的量之比进行反应,其离子方程式为2A13++3SO42-+3Ba2++8OH=2A1O2-+3BaSO4↓+4H2O,故答案为:2A13++3SO42-+3Ba2++8OH=2A1O2-+3BaSO4↓+4H2O;
(3)碳酸钠中的碳酸根离子和硫酸铝中的铝离子之间会发生双水解反应:2A13++3CO32-+6 H2O=2A1(OH)3↓+3CO2↑,故答案为:2A13++3CO32-+6 H2O=2A1(OH)3↓+3CO2↑.
点评:本题考查无机物的推断,题目较为综合,难度较大,正确推断各种物质为解答本题的关键.

练习册系列答案
相关题目
当光束通过下列分散系时,不能观察到丁达尔效应的是( )
| A、淀粉溶液 |
| B、食盐溶液 |
| C、Fe(OH)3溶液 |
| D、豆浆 |
下列离子方程式中,正确的是( )
| A、铜跟硝酸银溶液反应:Cu+Ag+═Cu2++Ag |
| B、碳酸氢钠溶液与稀硫酸混合:CO32-+2H+═CO2↑+H2O |
| C、碳酸钙与盐酸的反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、硫酸铜溶液与氯化钡溶液混合:CuSO4+Ba2+═BaSO4↓+Cu2+ |
下列各组指定的元素,不能形成AB2型化合物的是( )
| A、[He]2s22p2和[He]2s22p4 |
| B、[Ne]3s23p4和[He]2s22p4 |
| C、[Ne]3s2和[He]2s22p5 |
| D、[Ne]3s1和[Ne]3s23p4 |
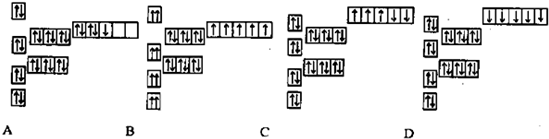
下列有关化学用语错误的是( )
A、Na+的基态电子排布图是: |
B、H2O分子的电子式为: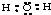 |
| C、Ca2+离子基态电子排布式为:1s22s22p63s23p6 |
D、氯原子结构示意图为: |
常温下,某澄清透明的溶液中可能存在:Fe2+、Cu2+、Mg2+、Al3+、SO32-、Br-、SO42-、NO3-等离子中的一种或几种,现进行了如下实验:

提示:SO32-与Al3+会发生双水解在水溶液中不能大量共存,SO32-与Fe2+、Cu2+、Mg2+会发生反应生成沉淀.
下列说法不正确的是( )

提示:SO32-与Al3+会发生双水解在水溶液中不能大量共存,SO32-与Fe2+、Cu2+、Mg2+会发生反应生成沉淀.
下列说法不正确的是( )
| A、沉淀B中可能含有氢氧化镁肯定含有氢氧化铁 |
| B、溶液中一定不存在SO32- |
| C、溶液中一定存在Fe2+、Al3+、Br-、SO42- |
| D、溶液中一定不存在Fe2+、Cu2+ |