题目内容
20.某学生用 Na2CO3和 KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)| 实验序号 | ① | ② | ③ | ④ |
| 盐酸体积/mL | 50 | 50 | 50 | 50 |
| 固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
| 生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
| A. | 实验②中,混合物过量 | |
| B. | 原混合物样品中 n(Na2CO3):n(KHCO3)=1:1 | |
| C. | 盐酸的物质的量浓度为 2 mol•L-1 | |
| D. | 实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g的混合物全部反应 |
分析 A、根据①②数据可知,固体质量扩大2 倍,生成气体的体积也扩大2倍;
B、根据①、②计算样品中碳酸钠和碳酸氢钾的物质的量之比;
C、根据④组盐酸完全反应求盐酸的浓度;
D、由C可知还有0.06mol的碳酸氢根离子未完全反应,所以还需0.06mol的盐酸.
解答 解:A、根据①②数据可知,固体质量扩大2 倍,生成气体的体积也扩大2倍,所以混合物完全反应,故A错误;
B、设原混合物样品中 n(Na2CO3)为xmol,n(KHCO3)为ymol,则:$\left\{\begin{array}{l}{x+y=\frac{0.672}{22.4}}\\{106x+100y=3.06}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{x=0.01}\\{y=0.02}\end{array}\right.$,原混合物样品中 n(Na2CO3):n(KHCO3)=1:2,故B错误;
C、根据④组固体质量12.24g,n(Na2CO3)为0.04mol,n(KHCO3)为0.08mol,碳酸钠首先转化为碳酸氢钠,消耗盐酸为:0.04mol,而碳酸氢根离子与盐酸反应生成二氧化碳1.344L,消耗盐酸为:0.06mol,所以盐酸的物质的量为0.06+0.04=0.1mol,c=$\frac{0.1mol}{50×1{0}^{-3}L}$=2 mol•L-1,故C正确;
D、由C可知还有0.06mol的碳酸氢根离子未完全反应,所以还需0.06mol的盐酸,V=$\frac{0.06}{2}$=0.03L,实验④反应后,至少需继续加入 30ml 的该盐酸溶液才能把12.24g的混合物全部反应,故D错误;
故选C.
点评 本题考查混合物的有关计算,难度中等,根据二氧化碳的体积变化判断盐酸是否完全反应式是关键,再根据气体体积与固体质量关系进行解答.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | 先加足量的KMnO4酸性溶液,然后再加入溴水 | |
| B. | 先加足量溴水,然后再加入KMnO4酸性溶液 | |
| C. | 点燃这种液体,然后再观察火焰的颜色 | |
| D. | 加入浓硫酸与浓硝酸后加热 |
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 |  |  |  |
①在一周的观察过程中,他发现实验序号为Ⅱ的试管中铁钉锈蚀速度最慢..
②下列防止钢铁锈蚀的措施不合理的是C(填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由电化学腐蚀造成的.
| A. | 石油的分馏是物理变化,得到的各个馏分都是纯净物 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| C. | CH3CH218OH和CH3COOH反应生成的水的相对分子质量为18 | |
| D. | 石油裂解可以得到乙烯,煤干馏得到的煤焦油中可以提取苯,乙烯和苯使溴水褪色的原理相同 |
| A. | 向溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明一定含有SO${\;}_{4}^{2-}$ | |
| B. | 向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有气体逸出,说明一定存在CO32-和AlO${\;}_{2}^{-}$ | |
| C. | 用焰色反应检验时,透过蓝色钴玻璃观察火焰呈紫色,则说明含有K+没有Na+ | |
| D. | 取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,说明不存在NH${\;}_{4}^{+}$、Al3+、Cu2+ |
| A. | HOCH2CHOHCOOH | B. | HO(CH2)2CHO | C. | HOOC-COOH | D. | CH3CH2COOH |
| A. |  2-甲基丁烷 2-甲基丁烷 | B. | (CH3)2CHCH2CH2OH 1-戊醇 | ||
| C. |  1,4-二甲苯 1,4-二甲苯 | D. |  2-甲基丙烯 2-甲基丙烯 |
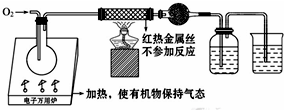 一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示: .
.