题目内容
16.含氯化镁、氯化钾、硫酸钠三种物质的混合液,已知其中氯离子有1.5mol,钾离子和钠离子共1.5mol,镁离子为0.5mol,则硫酸根离子的物质的量为( )| A. | 0.1mol | B. | 0.5mol | C. | 0.15mol | D. | 0.25mol |
分析 溶液不显电性,则阴离子的电荷总数=阳离子的电荷总数,以此来解答.
解答 解:氯离子有1.5mol,钾离子和钠离子共1.5mol,镁离子为0.5mol,设硫酸根离子的物质的量为x,
由溶液不显电性可知,1.5+x×2=1.5+0.5×2,解得x=0.5mol,
故选B.
点评 本题考查物质的量的计算,为高频考点,把握溶液为电中性为解答的关键,侧重分析与计算能力的考查,注意电荷守恒的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列实验操作中叙述正确的是( )
| A. | 萃取操作必须在分液漏斗中进行 | |
| B. | 用剩的药品应收集起来放回原试剂瓶中 | |
| C. | 振荡试管中液体时,手拿住试管,用手腕甩动 | |
| D. | 称量物质时先取小砝码,再依次取较大的砝码 |
4.根据图,下列判断中正确的是( )
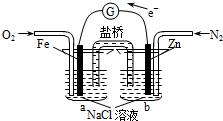

| A. | 该装置将电能转化为化学能 | B. | Fe电极发生了氧化反应 | ||
| C. | 烧杯a中的溶液pH降低 | D. | 烧杯b中发生的反应为Zn-2e-=Zn2+ |
11.下列文字表述与离子方程式对应且正确的是( )
| A. | 用石墨作电极电解NaCl溶液:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$C12↑+2OH-+H2↑ | |
| B. | 硫氢化钠的水解:HS-+H2O?H3O++S2- | |
| C. | 硫化钠的水解:S2-+2H2O?H2S+2OH- | |
| D. | 碳酸氢钠与氢氧化钠溶液的反应:HCO3-+OH-=CO32-+H2O |
1.在下列条件下,两种气体的分子数一定相等的是( )
| A. | 同质量不同密度的C2H4和CO | B. | 同温度同体积的C2H6和NO2 | ||
| C. | 同温度同密度的CO2和N2 | D. | 同体积同压强的N2和C2H2 |
8.从500mL1mol/L NaOH溶液中取出100mL溶液,对这100mL溶液的叙述中正确的是( )
| A. | Na+物质的量浓度为0.2mol/L | B. | 溶液中含1mol NaOH | ||
| C. | 溶液中含4gNaOH | D. | 物质的量浓度为0.2 mol/L |
5.硅及其化合物在材料领域中应用广泛.下列叙述中,正确的是( )
| A. | 晶体硅是良好的半导体材料 | |
| B. | 硅用于光导纤维 | |
| C. | SiO2不溶于水,也不溶于任何酸 | |
| D. | 用带玻璃瓶塞的试剂瓶盛放NaOH溶液 |
6.下列陈述I、II均正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe2O3是红棕色粉末 | Fe2O3常用作红色涂料 |
| B | SiO2是两性氧化物 | SiO2可和HF反应 |
| C | Al2O3难溶于水 | Al2O3可用作耐火材料 |
| D | SO2有氧化性 | SO2可使溴水褪色 |
| A. | A | B. | B | C. | C | D. | D |