题目内容
11.下列文字表述与离子方程式对应且正确的是( )| A. | 用石墨作电极电解NaCl溶液:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$C12↑+2OH-+H2↑ | |
| B. | 硫氢化钠的水解:HS-+H2O?H3O++S2- | |
| C. | 硫化钠的水解:S2-+2H2O?H2S+2OH- | |
| D. | 碳酸氢钠与氢氧化钠溶液的反应:HCO3-+OH-=CO32-+H2O |
分析 A.电解生成NaOH、氢气、氯气;
B.水解生成氢硫酸、氢氧根离子;
C.水解分步进行,以第一步为主;
D.发生复分解反应生成碳酸钠和水.
解答 解:A.用石墨作电极电解NaCl溶液的离子反应为2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$C12↑+2OH-+H2↑,故A正确;
B.硫氢化钠的水解的离子反应为HS-+H2O?H2S+OH-,故B错误;
C.硫化钠的水解的离子反应为S2-+H2O?HS-+OH-,故C错误;
D.碳酸氢钠与氢氧化钠溶液的反应的离子反应为HCO3-+OH-=CO32-+H2O,故D正确;
故选AD.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
4.在pH=1的溶液中能大量共存的离子组是( )
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、S2O32-、NO3- | ||
| C. | Al3+、Fe3+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、AlO2- |
1.材料、能源、信息、环境与化学关系密切,下列说法不正确的是( )
| A. | 我们使用合金是因为它比纯金属具有更优良的机械性能 | |
| B. | 钢化玻璃、有机玻璃、石英玻璃均属于硅酸盐材料 | |
| C. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| D. | 高纯度的二氧化硅广泛应用于制作光导纤维,光导纤维遇强碱会“断路” |
6.下列反应中,属于取代反应的是( )
| A. | CH4+2O2$\stackrel{点燃}{→}$ CO2+2H2O | B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | ||
| C. | CH4$\stackrel{高温}{→}$ C+2H2 | D. | 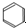 +HO-NO2$→_{△}^{浓硫酸}$H2O+ +HO-NO2$→_{△}^{浓硫酸}$H2O+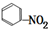 |
16.含氯化镁、氯化钾、硫酸钠三种物质的混合液,已知其中氯离子有1.5mol,钾离子和钠离子共1.5mol,镁离子为0.5mol,则硫酸根离子的物质的量为( )
| A. | 0.1mol | B. | 0.5mol | C. | 0.15mol | D. | 0.25mol |
3.用于净化汽车尾气的反应:2NO(g)+2CO(g)?2CO2(g)+N2(g),已知570K时该反应正向进行的程度很大,但速率极慢.下列说法正确的是( )
| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO | |
| B. | 升温能使反应物活化分子的百分数增加,所以提高尾气净化效率还需要升高温度 | |
| C. | 提高尾气净化效率的最佳途径是研制高效催化剂 | |
| D. | 因该反应正向进行的程度已经很大,故使用催化剂并无实际意义 |
20.某物质中可能有甲醇、甲酸、乙醇、甲酸乙酯几种物质中的一种或几种,在鉴定时有下列现象:①能发生银镜反应 ②加入新制的Cu(OH)2悬浊液,沉淀不溶解 ③与含酚酞的NaOH溶液共热时,发现溶液中红色逐渐变浅.下列叙述正确的是( )
| A. | 有甲酸乙酯和甲酸 | B. | 有甲酸乙酯和乙醇 | ||
| C. | 有甲酸乙酯,可能有乙醇 | D. | 几种物质都有 |
 ⑨淀粉和纤维素
⑨淀粉和纤维素