题目内容
(1)室温下pH=9的NaOH溶液和 pH=9的CH3COONa溶液中,设由水电离产生的c(OH-),分别为Amol/L和Bmol/L,则A和B 的关系为:A B.[填>或<或=]
(2)室温时,将pH=5的H2SO4稀释10倍,c(H+):c(SO42-)= ,将稀释后的溶液再稀释100倍,c(H+):c(SO42-)= .
(2)室温时,将pH=5的H2SO4稀释10倍,c(H+):c(SO42-)=
考点:酸碱混合时的定性判断及有关ph的计算,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)碱抑制水电离,含有弱酸根离子的盐促进水电离,所以氢氧化钠溶液中水电离出的c(OH-) 等于C(H+),醋酸钠溶液中水电离出的c(OH-) 等于水离子积常数与C(H+)的比值;
(2)稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离.
(2)稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离.
解答:
解:(1)氢氧化钠抑制水电离,醋酸钠促进水电离,所以氢氧化钠溶液中水电离出的c(OH-)等于c(H+),醋酸钠溶液中水电离出的c(OH-)等于水离子积常数与C(H+)的比值,则氢氧化钠溶液中水电离出的c(OH-)=10-9 mol/L,醋酸钠溶液中水电离出的c(OH-)=
mol/L=10-5 mol/L,所以A:B=10-4:1,所以A<B,
故答案为:<;
(2)将pH=5的H2SO4稀释10倍,溶液中的氢离子和硫酸根离子同等倍数的减小,所以两者之比为:2:1,稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离,所以将pH=5的硫酸溶液稀释100倍后,溶液中的SO42-与H+浓度的比值约为1:20,
故答案为:2:1;20:1.
| 10-14 |
| 10-9 |
故答案为:<;
(2)将pH=5的H2SO4稀释10倍,溶液中的氢离子和硫酸根离子同等倍数的减小,所以两者之比为:2:1,稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离,所以将pH=5的硫酸溶液稀释100倍后,溶液中的SO42-与H+浓度的比值约为1:20,
故答案为:2:1;20:1.
点评:本题考查了弱电解质的电离、pH的计算等知识点,易错点是(2),注意当酸无限稀释时溶液中氢离子浓度要考虑水的电离,酸性溶液不能变为中性或碱性,为易错点.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列有机反应类型判断错误的是( )
| A、CH4+Cl2→CH3Cl+HCl 取代反应 | ||
B、CH2=CH2+HCl
| ||
C、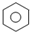 +Br2 +Br2
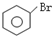 +HBr 取代反应 +HBr 取代反应 | ||
D、2CH3CH2OH+O2
|
下列说法正确的是( )
| A、Ni的还原性比铁稍弱,可采用金属铝作还原剂的热还原法 |
| B、在新制的氯水中加入NaOH溶液至中性时,满足C(Na+)═C(ClO-)+C(HClO) |
| C、在某溶液中加入K3Fe(CN)6若产生蓝色沉淀即可证明Fe3+ 的存 |
| D、在相同温度下,向1mL 0.2mol?L-1 NaOH溶液中滴入2滴0.1 mol?L-1 MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol?L-1 FeCl3溶液,又生成红褐色沉淀,可证明Fe(OH)3的溶解度小于Mg(OH)2 |


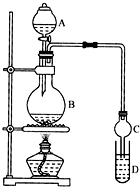 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下: