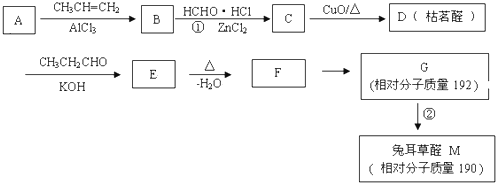
题目内容
现有50mL密度为1.18g/mL、质量分数为36.5%的浓盐酸:求
(1)此浓盐酸的物质的量浓度
(2)这50ml浓盐酸中所溶解的HCl气体在标准状况下的体积是多少L?
(1)此浓盐酸的物质的量浓度
(2)这50ml浓盐酸中所溶解的HCl气体在标准状况下的体积是多少L?
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:(1)根据物质的量浓度c=
计算该盐酸的物质的量浓度;
(2)计算出氯化氢的物质的量,根据V=nVm计算出标况下氯化氢的体积.
| 1000ρω |
| M |
(2)计算出氯化氢的物质的量,根据V=nVm计算出标况下氯化氢的体积.
解答:
解:(1)该盐酸的物质的量浓度为:c(HCl)=
mol/L=11.8 mol/L,
答:此浓盐酸的物质的量浓度为11.8mol/L;
(2)50mL该浓盐酸中氯化氢的物质的量为:n(HCl)=11.8 mol/L×0.05 L=0.59 mol,
需要标况下氯化氢的体积为:V(HCl)=0.59 mol×22.4 L/mol=13.216 L,
答:这50ml浓盐酸中所溶解的HCl气体在标准状况下的体积是13.216 L.
| 1000×1.18×36.5% |
| 36.5 |
答:此浓盐酸的物质的量浓度为11.8mol/L;
(2)50mL该浓盐酸中氯化氢的物质的量为:n(HCl)=11.8 mol/L×0.05 L=0.59 mol,
需要标况下氯化氢的体积为:V(HCl)=0.59 mol×22.4 L/mol=13.216 L,
答:这50ml浓盐酸中所溶解的HCl气体在标准状况下的体积是13.216 L.
点评:本题考查了物质的量浓度与溶质质量分数的计算,题目难度中等,注意掌握物质的量浓度与溶质质量分数的转化关系,明确物质的量浓度的概念及计算方法,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
温室效应引起国际的关注,我国也积极应对,采取措施.中科院首创用CO2合成可降解塑料聚二氧化碳.下列相关说法合理的是( )
| A、聚二氧化碳塑料是合成高分子材料 |
| B、聚二氧化碳塑料与干冰互为同素异形体 |
| C、聚二氧化碳塑料的使用也会产生白色污染 |
| D、聚二氧化碳塑料与干冰是同一种物质 |
通过置换反应不可能生成( )
| A、A12O3 |
| B、O2 |
| C、F2 |
| D、C |
硝酸与CuS发生反应为CuS+HNO3→Cu(NO3)2+NO2↑+S↓+H2O,配平后可知8mol硝酸参加反应实际得到的电子数是( )
| A、1.448×1025个 |
| B、7.260×1024个 |
| C、2.408×1024个 |
| D、1.806×1025个 |
已知乙醇密度小于水,质量分数为96%的酒精溶液的物质的量浓度为16.6mol?L-1,试判断8.3mol?L-1的酒精溶液的溶质的质量分数为( )
| A、大于48% | B、等于48% |
| C、小于48% | D、无法确定 |
1mol O2在放电条件下发生下列反应:3O2
2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
| ||
| A、17.8 | B、16 |
| C、18.4 | D、35.6 |
下列离子方程式,书写正确的是( )
| A、硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ |
| B、氯化铁溶液中加入过量氨水 Fe3++3OH-=Fe(OH)3↓ |
| C、铝粉投入到NaOH溶液中 2Al+2OH-═2AlO2-+H2↑ |
| D、硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |