题目内容
硝酸与CuS发生反应为CuS+HNO3→Cu(NO3)2+NO2↑+S↓+H2O,配平后可知8mol硝酸参加反应实际得到的电子数是( )
| A、1.448×1025个 |
| B、7.260×1024个 |
| C、2.408×1024个 |
| D、1.806×1025个 |
考点:氧化还原反应
专题:
分析:CuS+HNO3→Cu(NO3)2+NO2↑+S↓+H2O反应中CuS中S元素化合由-2价升高为0价,HNO3中N元素由-5降低为+4,结合化合价变化计算失去电子物质的量.
解答:
解:CuS+HNO3→Cu(NO3)2+NO2↑+S↓+H2O反应中CuS中S元素化合由-2价升高为0价,HNO3中N元素由-5降低为+4,
配平方程式为:CuS+4HNO3=Cu(NO3)2+2NO2↑+S↓+2H2O,则4molHNO3中有2mol被还原,转移2mol电子,则8mol硝酸参加反应实际得到的电子4mol,即2.408×1024个,
故选C.
配平方程式为:CuS+4HNO3=Cu(NO3)2+2NO2↑+S↓+2H2O,则4molHNO3中有2mol被还原,转移2mol电子,则8mol硝酸参加反应实际得到的电子4mol,即2.408×1024个,
故选C.
点评:本题考查氧化还原反应的有关计算,比较基础,注意根据化合价理解基本概念与电子转移计算.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
莽草酸可用于合成药物达菲,其结构简式如图所示,下列关于莽草酸的说法正确的( )
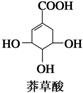

| A、能使FeCl3溶液显色 |
| B、分子中含有2种官能团 |
| C、可发生加成和取代反应 |
| D、分子中所有原子可以共平面 |
下列分子式只表示一种纯净物的是( )
| A、C2H6O |
| B、C3H8 |
| C、C4H10 |
| D、C |
下列金属中,能与氯气和盐酸反应,且两反应生成相同氯化物的是( )
| A、Fe | B、Al | C、Cu | D、Ag |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
| ||
| A、KClO3在反应中得到电子 |
| B、H2SO4是该反应的氧化剂 |
| C、H2C2O4在反应中被还原 |
| D、1 mol KClO3参加反应,有2mol电子转移 |
同温同压下,等体积的N2和NH3,具有相同的( )
| A、密度 | B、分子数 |
| C、氮原子数 | D、质量 |