题目内容
7.用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是( )| A. | 相同状况下两电极上产生的气体体积之比为2:1 | |
| B. | 两电极上产生的气体质量之比为8:1 | |
| C. | 相同状况下两电极上产生的气体体积之比为4:1 | |
| D. | 若两电极上产生的气体质量比为16:3,则D2O与H2O的物质的量之比为2:1 |
分析 先根据方程式判断氢气和氧气的体积之比,根据电路中有4mol电子通过时计算氧气的质量,再利用质量和计算氢气的质量,最后列方程组进行计算.
解答 解:电解水的方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,由方程式知,氢气和氧气的体积之比为2:1,当电路中有4mol电子通过时,生成氢气为2mol,生成氧气为1mol,则氧气的质量=1×32=32g,因为气体质量比为16:3,所以2mol氢气的质量为6g,所以氢气的平均摩尔质量=$\frac{6g}{2mol}$=3g/mol,所以十字交叉: ,则D2O与H2O的物质的量之比为1:1,
,则D2O与H2O的物质的量之比为1:1,
故选A.
点评 本题以电解原理为载体考查了物质的量的有关计算,题目难度中等,充分利用平均摩尔质量法是解答本题的关键.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
7.草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解.常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5.回答下列问题:
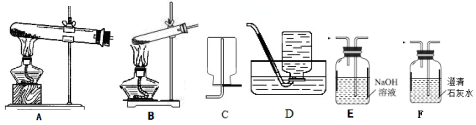
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为B-E-D(填字母序号).
(2)相同温度条件下,分别用3支试管按下列要求完成实验:
写出试管B的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”?能(选填“能”或“不能”);简述你的理由:实验中KMnO4的浓度cB>cA,且其反应速率νB>νA.
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有AC(填序号).
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH>7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH<a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL.
①所用指示剂为酚酞;滴定终点时的现象为锥形瓶内溶液由无色变成(粉)红色,且半分钟内不变化;
②H2C2O4溶液物质的量浓度为0.05000mol/L;
③下列操作会引起测定结果偏高的是AD(填序号).
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数.
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为B-E-D(填字母序号).

(2)相同温度条件下,分别用3支试管按下列要求完成实验:
| 试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
| 褪色时间 | 28秒 | 30秒 | 不褪色 |
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有AC(填序号).
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH>7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH<a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL.
①所用指示剂为酚酞;滴定终点时的现象为锥形瓶内溶液由无色变成(粉)红色,且半分钟内不变化;
②H2C2O4溶液物质的量浓度为0.05000mol/L;
③下列操作会引起测定结果偏高的是AD(填序号).
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数.
8.下列有关卤代烃说法正确的是( )
| A. | 检验溴乙烷中是否有溴元素,方法是先加入NaOH溶液共热,冷却后用过量稀硝酸中和过量碱,再加硝酸银溶液,观察有无浅黄色沉淀生成 | |
| B. | 卤代烃水解后的有机产物一定为醇 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 所有卤代烃都是通过取代反应制得的 |
5.某同学用下列装置制备并检验Cl2的性质.下列说法正确的是( )
| A. | 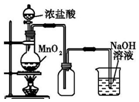 图中:如果MnO2过量,浓盐酸就可全部消耗 | |
| B. |  图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照,量筒内最后剩余气体为HCl和氧气 | |
| C. | 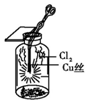 图中:生成蓝色的烟 | |
| D. | 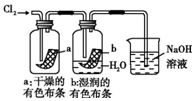 图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
12.一定量的液态化合物XY3,在一定量O2中恰好完全反应:XY3(l)+4O2(g)═XO2(g)+3YO2(g),冷却后在标准状况下,测得生成物的体积为560mL,密度为3.20g•L-1.下列说法中错误的是( )
| A. | 反应前O2的体积为560 mL | B. | 化合物XY3的摩尔质量为86 g/mol | ||
| C. | XY3的质量为0.99g | D. | 反应后气体总质量约为1.79 g |
19. 实验室需要制备、干燥和收集:①CO2、②Cl2、③SO2、④O2、⑤NO、⑥NO2、⑦H2、⑧NH3,其中能用如图所示装置进行实验的是( )
实验室需要制备、干燥和收集:①CO2、②Cl2、③SO2、④O2、⑤NO、⑥NO2、⑦H2、⑧NH3,其中能用如图所示装置进行实验的是( )
 实验室需要制备、干燥和收集:①CO2、②Cl2、③SO2、④O2、⑤NO、⑥NO2、⑦H2、⑧NH3,其中能用如图所示装置进行实验的是( )
实验室需要制备、干燥和收集:①CO2、②Cl2、③SO2、④O2、⑤NO、⑥NO2、⑦H2、⑧NH3,其中能用如图所示装置进行实验的是( )| A. | ①②③④⑥ | B. | ⑤⑦⑧ | C. | ①②③④⑤⑥ | D. | ①②③④⑤⑥⑦⑧ |
16.下列解释事实的方程式不正确的是( )
| A. | 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2═2Na2O | |
| B. | 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 硫酸铵溶液与氢氧化钡溶液混合,产生气体:NH4++OH-═NH3↑十+H2O | |
| D. | 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-═Ag2S↓+2I- |
17.下列实验的反应原理用离子方程式表示正确的是( )
| A. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| B. | 室温下,测得氯化铵溶液pH<7:NH4++H2O=NH3•H2O+H+ | |
| C. | 石灰水中加入过量碳酸氢钠溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 用小苏打片治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
