题目内容
9.下列属于非电解质的是( )| A. | 干冰 | B. | 液氯 | C. | 氯化钠固体 | D. | 水 |
分析 在水溶液里或熔融状态下都不导电的化合物是非电解质,在水溶液里或熔融状态下能导电的化合物是电解质;单质和混合物既不是电解质和不是非电解质.
解答 解:A、干冰为二氧化碳,在水溶液里和水反应生成电解质,本身不能电离,所以干冰是非电解质,故A正确;
B.液氯是单质不是化合物,所以既不是电解质也不是非电解质,故B错误;
C.氯化钠是化合物,水溶液中或熔融状态下电离出离子导电,所以氯化钠是电解质,故C错误;
D.水是弱电解质含有自由移动的离子所以能导电,故水是电解质,故D错误;
故选A.
点评 本题考查了电解质和非电解质的判断,难度不大,明确电解质、非电解质的概念为解答关键,注意无论电解质还是非电解质都必须是化合物.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
4.下列说法中正确的是( )
| A. | 烷烃中除甲烷外,很多烷烃都能被酸性KMnO4溶液氧化 | |
| B. | 烯烃、炔烃、苯都能发生化学反应使溴的四氯化碳溶液褪色 | |
| C. | 乙烯、乙炔、乙烷的分子中所有原子都在同一平面上 | |
| D. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 molH2O |
5.利用下图所示联合装置制备金属钛,下列叙述错误的是( )

| A. | 甲装置工作过程中pH增大 | |
| B. | 乙装置中石墨电极反应式为C-4e-+2O2-═CO2↑ | |
| C. | 甲装置中通入O2的电极反应式为:O2+4e-+4H+═2H2O | |
| D. | 若不考虑装置的损失,制备24.0g金属钛,需要消耗氢气22.4L |
17.某有机化合物的结构简式如图所示,下列说法正确的是( )
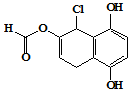

| A. | 不能发生银镜发应,能发生水解反应 | |
| B. | 1mol 该物质最多可与含2mol溴单质的浓溴水反应 | |
| C. | 1mol 该物质最多可与4molNaOH反应 | |
| D. | 与Na、NaHCO3、Na2CO3均能发生反应 |
4.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的最高正价与最低负价的代数和为2,Y是地壳中含量最多的元素,Z原子的最外层电子数是Y原子的最外层电子数的一半,W与Y同主族.下列说法正确的是( )
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | 元素X、Y组成的化合物只有两种 | |
| C. | W的简单气态氢化物的热稳定性比Y的弱 | |
| D. | Q、Z的简单离子具有相同的电子层结构 |
14.实验室处理废催化剂FeBr3溶液,得到溴的苯溶液和无水FeCl3.下列设计能达到相应验目的是( )

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙使Br-全部转化为溴单质 | |
| C. | 用装置丙分液时先从下口放出水层,再从上口倒出有机层 | |
| D. | 用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl3 |
1.常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
则元素Y第一电离能大于X的原因是Mg为3s2构型,完全充满状态,是一种稳定结构;
(3)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②1mol CN-中π键数目为2NA .
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(3)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②1mol CN-中π键数目为2NA .
18.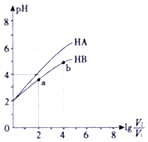 在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是( )
在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是( )
 在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是( )
在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是( )| A. | a、b两点水的电离程度a小于b | |
| B. | HA、HB两种酸溶液pH相同时,c(HA)<c(HB) | |
| C. | 曲线上a、b两点$\frac{c({B}^{-})}{c(HB)•(O{H}^{-})}$一定相等 | |
| D. | 25℃时,NaA溶液中c(A-)一定大于NaB溶液中c(B-) |
11. 常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
 常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )| A. | 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大 | |
| B. | 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性 | |
| C. | 氨水与HA溶液混合后的溶液中可能存在:c(NH4+)>c(A-)>c(H+)>c(OH-) | |
| D. | 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB |