题目内容
6.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.下列资料表示了三种金属被人类开发利用的大致年限.
(1)上述资料中的三种常用金属的开发利用之所以有先后,主要取决于D.
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性大小
(2)早在西汉成书的《淮南万毕术》里,就有“曾青得铁则化为铜”的记载.曾青又有空青、白青、石胆、胆矾等名称,其实都是天然的硫酸铜.
①写出“曾青得铁则化为铜”的化学方程式Fe+CuSO4=Cu+FeSO4.
②若根据上述反应设计成原电池,请在图2方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式.
正极反应:Cu2++2e-=Cu;
负极反应:Fe-2e-=Fe2+.
分析 (1)由图可以判断出金属活动性与开发利用的先后关系;
(2)①铁和硫酸铜溶液发生置换反应;
②原电池的总反应为Fe+Cu2+=Fe2++Cu,根据原电池反应设计原电池,原电池正极材料为较不活泼金属或非金属材料,正极上发生还原反应;
解答 解:(1)由图示可以看出金属的活动性大小与金属的开发利用的先后有关,金属活泼性越强的金属开发利用越晚,和金属活泼性有关,
故答案为:D;
(2)①曾青得铁则化为铜是铁和硫酸铜溶液发生置换反应,反应的方程化学式为:Fe+CuSO4=Cu+FeSO4,
故答案为:Fe+CuSO4=Cu+FeSO4 ;
②原电池的总反应为Fe+Cu2+=Fe2++Cu,则该原电池中,Fe为负极,负极反应Fe-2e-=Fe2+,Cu(或C)为正极,正极发生还原反应,电极反应式为Cu2++2e-=Cu,电解质溶液为硫酸铜溶液,
则原电池装置为 ,
,
故答案为: ;Cu2++2e-=Cu;Fe-2e-=Fe2+;
;Cu2++2e-=Cu;Fe-2e-=Fe2+;
点评 本题考查金属的冶炼、离子方程式书写、原电池设计、电极反应式书写,题目难度不大,注意注意电极反应式的书写.

练习册系列答案
相关题目
16.下列说法不正确的是( )
| A. | 聚合物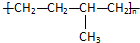 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 | |
| B. | 将1 mol明矾晶体完全溶于水制成胶体,其中所含胶体微粒数目为NA | |
| C. | 乙醇、苯酚、乙酸都有羟基,但是电离常数不同,这主要是基团之间相互影响造成的 | |
| D. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 |
17.下列反应属于加成反应的是( )
| A. | 由乙烯与水反应制乙醇 | B. | 由甲烷制四氯化碳 | ||
| C. | 苯与浓硫酸、硝酸混合 | D. | 点燃乙醇 |
11.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 上述现象说明[Cu(NH3)4]2+不如Cu(OH)2稳定 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤电子对,NH3提供空轨道 |
15.下列关于元素周期表的叙述,错误的是( )
| A. | 第IA族元素全部是金属元素 | |
| B. | 过渡元素全是金属元素 | |
| C. | 第ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 在元素周期表中金属与非金属的分界线附近可以寻找制造半导体的材料 |
16.下列粒子中,对H2O的电离平衡不产生影响的是( )
| A. |  | B. | 26M3+ | C. |  | D. | CH3COONa |
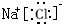 .
.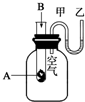 为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题: