题目内容
3.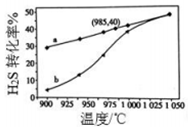 废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.
废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.(1)某温度时,测得反应体系中有气体1.3lmol,反应1min后,测得气体为l.37mol,则1min 内H2的生成速率为0.04mol/(L•min).
(2)某温度时,H2S的转化率达到最大值的依据是a、c(选填编号).
a.气体的压强不发生变化 b.气体的密度不发生变化
c.$\frac{{c}^{2}({H}_{2})•c({S}_{2})}{{c}^{2}({H}_{2}S)}$不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如图.图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率.该反应为吸热反应(填“放热”或“吸热”).曲线b随温度的升高,向曲线a接近的原因是随着温度升高,反应速率加快,达到平衡所需要的时间变短.在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是升高反应温度(或及时分离S2气体).
(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是19.5L.若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4KJ的热量,该反应的热化学方程式是H2S(g)+$\frac{3}{2}$O2(g)→SO2(g)+H2O(g)△H=-499.8kJ/mol.
分析 (1)根据方程式知,反应前后气体增加的物质的量相当于n(S2),则反应前后生成的n(S2)=(1.37-1.31)mol=0.06mol,则v(S2)=$\frac{\frac{0.06mol}{3L}}{1min}$=0.02mol/(L.min),v(H2)=2v(S2);
(2)某温度时,H2S的转化率达到最大值时说明该反应达到平衡状态,当反应前后改变的物理量不变时,该反应就达到平衡状态;
(3)升高温度平衡向吸热方向移动;温度越高化学反应速率越快;在容器体积不变的情况下,如果要提高H2的体积分数,应该使平衡正向移动但不能减少氢气的量;
(4)H2S与空气中的O2高温时发生后恢复室温,反应的方程式为:2H2S(g)+O2(g)═2H2O(l)+S2(g),根据反应方程式计算混合气体的体积,2gH2S完全燃烧后生成二氧化硫和水蒸气,反应方程式为:H2S+$\frac{3}{2}$O2(g)$\frac{\underline{\;点燃\;}}{\;}$SO2(g)+H2O(g),根据热量关系计算反应的焓变,写出热化学方程式.
解答 解:(1)根据方程式知,反应前后气体增加的物质的量相当于n(S2),则反应前后生成的n(S2)=(1.37-1.31)mol=0.06mol,则v(S2)=$\frac{\frac{0.06mol}{3L}}{1min}$=0.02mol/(L.min),v(H2)=2v(S2)=2×0.02mol/(L•min),
故答案为:0.04mol/(L•min);
(2)某温度时,H2S的转化率达到最大值时说明该反应达到平衡状态,当反应前后改变的物理量不变时,该反应就达到平衡状态,
a.该反应前后气体物质的量之和改变,说明反应前后混合气体压强改变,当气体的压强不发生变化时,该反应达到平衡状态,故a正确;
b.反应前后混合气体总质量不变、容器体积不变,所以无论反应是否达到平衡状态,气体的密度始终不变,所以不能据此判断平衡状态,故b错误;
c.$\frac{{c}^{2}({H}_{2})•c({S}_{2})}{{c}^{2}({H}_{2}S)}$=K,K只有温度有关,根据图知,反应中温度是不断变化的,则K不断变化,当K不变时该反应达到平衡状态,故c正确;
d.无论反应是否达到平衡状态,都存在单位时间里分解的H2S和生成的H2一样多,所以不能据此判断平衡状态,故d错误;
故选ac;
(3)升高温度平衡向吸热方向移动,根据图象,随着温度升高,H2S的平衡转化率升高,则正反应是吸热反应,
线b随温度的升高,向曲线a接近,从化学反应速率角度考虑,温度越高化学反应速率越快,则原因是:随着温度升高,反应速率加快,达到平衡所需要的时间变短,从而转化率与a逼近,
在容器体积不变的情况下,如果要提高H2的体积分数,应该使平衡正向移动但不能减少氢气的量,则可以考虑采取的措施有:升高反应温度(或及时分离S2气体),
故答案为:吸热;随着温度升高,反应速率加快,达到平衡所需要的时间变短;升高反应温度(或及时分离S2气体);
(4)H2S与空气中的O2高温时发生后恢复室温,反应的方程式为:2H2S(g)+O2(g)═2H2O(l)+S2(g),使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,反应物为1LH2S(g)和4LO2,反应O2过量,消耗O20.5L,产生1LS2(g),因此混合气体的体积为V=20L+1L-1L-0.5L=19.5L,
2gH2S完全燃烧后生成二氧化硫和水蒸气,反应方程式为:H2S+$\frac{3}{2}$O2(g)$\frac{\underline{\;点燃\;}}{\;}$SO2(g)+H2O(g),2gH2S的物质的量为$\frac{2g}{34g/mol}$=$\frac{1}{17}mol$,放出29.4KJ的热量,则1molH2S反应放出热量为29.4kJ×17=499.8kJ,则反应的焓变为△H=-499.8kJ/mol,热化学方程式为:H2S(g)+$\frac{3}{2}$O2(g)→SO2(g)+H2O(g)△H=-499.8kJ/mol,
故答案为:19.5;H2S(g)+$\frac{3}{2}$O2(g)→SO2(g)+H2O(g)△H=-499.8kJ/mol.
点评 本题主要考查化学原理部分知识,包含化学反应速率的计算,化学平衡的判断和化学平衡的移动,热化学方程式的书写和计算,根据化学方程式的计算,是综合性试题,涉及的知识点较多,题目难度中等,均为高频考点.

| A. | Na2CO3 | B. | NH4Cl | C. | CH3COONa | D. | H2SO4 |
| A. | 1L0.1mol/L盐酸和1L0.1mol/L硫酸分别与1L2mol/LNaOH溶液反应的反应速率相同 | |
| B. | 化学反应速率为0.8mol/(L•s),其含义是时间为1s时,某物质的浓度是0.8mol/L | |
| C. | 等体积的0.1mol/L盐酸和0.1mol/L硝酸与形状和大小相同的大理石反应的速率相同 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 |
| A. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| B. | 0.5 mol•L-1的所有一元酸中氢离子浓度都是0.5 mol/L | |
| C. | 强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度 | |
| D. | 电解质溶液导电的原因是溶液中有自由移动的阴阳离子 |
| A. | 含17个中子的镁元素的核素符号:${\;}_{17}^{29}$Mg | |
| B. | CH4分子的比例模型: | |
| C. | S2-离子的结构示意图: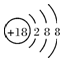 | |
| D. | HF的电子式: |
| A. | 元素X和Y、Z、W都能形成共价化合物 | |
| B. | 离子半径从大到小的顺序为:W+>Y2->Z- | |
| C. | X、Y的最高和最低化合价的代数和分别为0、4 | |
| D. | Z的单质和Y的低价氧化物都能漂白干燥织物 |
| A. | 溴苯中的溴(KOH溶液) | B. | 苯中的甲苯(溴水) | ||
| C. | 苯中的苯酚(溴水) | D. | 乙烷中的乙烯(酸性KMnO4) |
 ,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式为3s23p5.
,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式为3s23p5. ,中心原子A的杂化方式sp3杂化,是非极性(填“极性”或“非极性”)分子.
,中心原子A的杂化方式sp3杂化,是非极性(填“极性”或“非极性”)分子.