题目内容
8.以下物质其中属于互为同位素的是③,同素异形体是⑥.(填序号)①CO、CO2 ②H2、D2、T2 ③${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl ④14 C、14 N ⑤液氨、氨水 ⑥O2、O3.
分析 质子数相同中子数不同的同一元素的不同原子互称同位素,同位素必须原子;
同一元素形成的不同单质称同素异形体,同素异形体必须是单质.
解答 解:①CO、CO2 是不同氧化物,
②H2、D2、T2 是氢气为同种物质,
③${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl质子数相同中子数不同的同种元素为同位素,
④14 C、14 N 质量数相同质子数不同为不同元素的原子,
⑤液氨是氨气、氨水是氨气的水溶液,
⑥O2、O3是同种元素组成的不同单质,为氧元素的同素异形体,
故答案为:③;⑥.
点评 本题考查同位素、同素异形体的概念,难度不大.对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
3.某溶液可能含有NH4+、Fe3、Fe2+、Na+,Cl-、SO42-、CO32-某同学为了确认其成分,取部分试液,设计并完成了如下实验:下列说法正确的是( )


| A. | NH4+、Cl-、SO42-离子一定存在,CO32-离子一定不存在 | |
| B. | 原溶液中c(Fe3+)=0.4mol•L-1 | |
| C. | 溶液中至少有4种离子存在,其中Na+一定存在,且c(Na+)≥0.6mol•L-1 | |
| D. | 取少量原溶液于试管中,先加入适量氯水,再加少量KSCN溶液,若溶液成血红 色,则含有Fe2+ |
4.下列说法正确的是( )
| A. | 向鸡蛋清的溶液中加入浓的硫酸铵溶液,蛋白质的性质发生改变并凝聚 | |
| B. | 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,下层析出肥皂 | |
| C. | 油脂为髙分子化合物,分子结构中都含有酯基 | |
| D. | 纤维素、麦芽糖在一定条件下均可转化为葡萄糖 |
1.下列物质分类不正确的是( )
| A. | 化合物:干冰、冰水共存物、烧碱、小苏打 | |
| B. | 同素异形体:活性炭、C60、石墨烯、金刚石 | |
| C. | 非电解质:氨气、二氧化硫、铜、乙醇 | |
| D. | 混合物:铝热剂、纯净矿泉水、分析纯盐酸、漂白粉 |
13.已知苯(  )分子有一类氢原子,其中二氯代物有3种,萘(
)分子有一类氢原子,其中二氯代物有3种,萘( )分子有两类氢原子,其中二氯代物有10种,蒽(
)分子有两类氢原子,其中二氯代物有10种,蒽(  ) 分子有三类氢原子,其中二氯代物有( )
) 分子有三类氢原子,其中二氯代物有( )
 )分子有一类氢原子,其中二氯代物有3种,萘(
)分子有一类氢原子,其中二氯代物有3种,萘( )分子有两类氢原子,其中二氯代物有10种,蒽(
)分子有两类氢原子,其中二氯代物有10种,蒽(  ) 分子有三类氢原子,其中二氯代物有( )
) 分子有三类氢原子,其中二氯代物有( )| A. | 13种 | B. | 15种 | C. | 18种 | D. | 20种 |
20.只含一个三键的炔烃A加氢后的产物的结构简式为 ,炔烃A可能的结构简式有( )
,炔烃A可能的结构简式有( )
 ,炔烃A可能的结构简式有( )
,炔烃A可能的结构简式有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
17. 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电子,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电子,装置如图所示.此电池工作时,下列叙述正确的是( )
 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电子,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电子,装置如图所示.此电池工作时,下列叙述正确的是( )| A. | 该电池的负极反应为Mg-2e-═Mg2+ | |
| B. | 铝条表面虽有氧化膜,但可不必处理 | |
| C. | 该电池的内电路中,阳离子向负极迁移 | |
| D. | Al作原电池负极,开始工作时溶液中会立即有白色沉淀析出 |
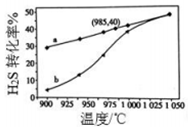 废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.
废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.