题目内容
下列说法正确的是( )
| A、元素铯的两种核素137Cs比133Cs多四个质子 |
| B、等质量的H2、D2、T2三种气体的电子数之比为2:3:6 |
| C、一种元素只能有一种质量数 |
| D、在氮原子中,质子数为7而中子数不一定为7 |
考点:质量数与质子数、中子数之间的相互关系
专题:原子组成与结构专题
分析:A、同种元素的原子质子数相同;
B、同位素原子含有相同的电子数;
C、一种元素可能有多种同位素;
D、氮元素是7号元素,其原子中含有7个质子.
B、同位素原子含有相同的电子数;
C、一种元素可能有多种同位素;
D、氮元素是7号元素,其原子中含有7个质子.
解答:
解:A、同种元素的原子质子数相同,所以137Cs比133Cs的质子数相同,故A错误;
B、同位素原子含有相同的电子数,每个H2、D2、T2分子中都含有2个电子,等质量H2、D2、T2三种气体的物质的量之比为6:3:2,所以含有的电子数之比为6:3:2,故B错误;
C、一种元素可能有多种同位素,所以一种元素可能有多种质量数,如H、D、T都属于氢元素,其质量数分别为1、2、3,故C错误;
D、氮元素是7号元素,其原子中含有7个质子,则在氮原子中,质子数为7而中子数不一定为7,故D正确.
故选D.
B、同位素原子含有相同的电子数,每个H2、D2、T2分子中都含有2个电子,等质量H2、D2、T2三种气体的物质的量之比为6:3:2,所以含有的电子数之比为6:3:2,故B错误;
C、一种元素可能有多种同位素,所以一种元素可能有多种质量数,如H、D、T都属于氢元素,其质量数分别为1、2、3,故C错误;
D、氮元素是7号元素,其原子中含有7个质子,则在氮原子中,质子数为7而中子数不一定为7,故D正确.
故选D.
点评:本题考查了原子结构,题目难度不大,注意对基础知识的掌握.

练习册系列答案
相关题目
下列离子中,不可能与H+大量共存于同一溶液中的是( )
A、S
| ||
| B、Cl- | ||
| C、Cu2+ | ||
D、N
|
用MnO2和浓盐酸制取氯气,当4mol氯化氢被氧化时,生成的氯气的体积(标况)是( )
| A、22.4L |
| B、44.8L |
| C、67.2L |
| D、89.6L |
硫酸铵[(NH4)2SO4]强热时分解产物为SO2、NH3、N2及H2O.根据氧化还原反应原理,不写方程式即可知道,产物中SO2与N2的体积之比为( )
| A、1:1 | B、2:1 |
| C、3:1 | D、1:3 |
下列对碱金属的叙述,其中完全不正确的组合是( )
①K通常保存在煤油中,以隔绝与空气的接触;
②碱金属常温下呈固态,取用时可直接用手拿;
③碱金属中还原性最强的是钾;
④碱金属阳离子,氧化性最强的是Li+;
⑤碱金属的原子半径和离子半径都随核电荷数的增大而增大;
⑥从Li到Cs,碱金属的密度越来越大,熔沸点越来越高.
①K通常保存在煤油中,以隔绝与空气的接触;
②碱金属常温下呈固态,取用时可直接用手拿;
③碱金属中还原性最强的是钾;
④碱金属阳离子,氧化性最强的是Li+;
⑤碱金属的原子半径和离子半径都随核电荷数的增大而增大;
⑥从Li到Cs,碱金属的密度越来越大,熔沸点越来越高.
| A、②③⑥ | B、②③④ |
| C、④⑤⑥ | D、①③⑤ |
密闭容器中的可逆反应 2HI(g)?I2(g)+H2(g),能说明反应达到平衡的是( )
| A、容器内压强不变 |
| B、单位时间内消耗2molHI,同时生成1molH2 |
| C、HI的浓度与I2的浓度相等 |
| D、混合气体的颜色不变 |
已知下列各组原子序数,其中能形成X2Y5型化合物的是( )
| A、17和13 | B、7和8 |
| C、15和17 | D、12和19 |
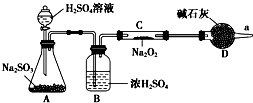 ①某学生根据SO2具有还原性判断SO2和Na2O2反应能生成硫酸钠,该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(A为SO2的发生装置,图中铁架台等装置已略去).
①某学生根据SO2具有还原性判断SO2和Na2O2反应能生成硫酸钠,该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(A为SO2的发生装置,图中铁架台等装置已略去).