题目内容
14.(l)配平下列反应方程式并标出电子转移的方向和数目:3FeO+10HNO3→3Fe(NO3)3+1NO↑+5H2O
(2)反应中Fe元素被氧化,当产生2.24L(标准状况)NO气体时,转移电子0.3NA个.
分析 硝酸中N元素的化合价降低,被还原,FeO中Fe元素的化合价升高,被氧化,根据化合价的变化计算转移的电子数目,据此分析.
解答 解:(1)硝酸中N元素的化合价从+5价降低到+2价,FeO中Fe元素的化合价从+2价升高到+3价,由电子守恒和原子守恒可知方程式为3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O,反应中转移电子数为3,则标出电子转移的方向和数目为为 ,
,
故答案为:3、10、3、1、5; ;
;
(2)FeO中Fe元素的化合价升高,Fe元素被氧化;当产生2.24L(标准状况)NO气体时,即生成0.1molNO转移电子为0.3mol,即0.3NA;
故答案为:Fe;0.3NA.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化及氧化还原反应中的基本概念即可解答,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
4.具有下列电子排布式的原子中,半径最大的是( )
| A. | ls22s22p63s23p5 | B. | 1s22s22p3 | C. | 1s22s22p4 | D. | 1s22s22p63s23p3 |
5.某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如图:下列有关推断不合理的是( )
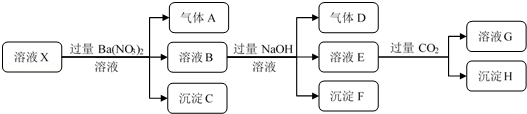

| A. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ | |
| B. | 沉淀H为Al(OH)3 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.15 mol•L |
2.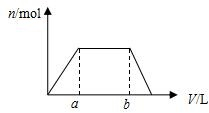 将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )
将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )
 将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )
将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )| A. | 10(b-a)/22.4 mol/L | B. | 20(b-a)/22.4 mol/L | ||
| C. | 10b/22.4 mol/L | D. | 10a/22.4 mol/L |
3.含等物质的量浓度的Na2S和NaBr的溶液中缓慢通入氯气,下列离子方程式不符合实际情况的是( )
| A. | S2-+Cl2═S↓+2Cl- | B. | S2-+2Br-+2Cl2═S↓+Br2+4Cl- | ||
| C. | 2S2-+2Br-+3Cl2═2S↓+Br2+6Cl- | D. | 3S2-+2Br-+4Cl2═3S↓+Br2+8Cl- |