题目内容
6.将200mL 0.1mol•L-1 Na2CO3溶液与含1.71gBa(OH)2的溶液混合后,为使混合液呈中性,需再加入1mol•L-1盐酸的体积为( )| A. | 30mL | B. | 40mL | C. | 50mL | D. | 60mL |
分析 将200mL 0.1mol•L-1 Na2CO3溶液与含1.71gBa(OH)2的溶液混合后,为使混合液呈中性,反应后溶质为BaCl2、NaCl,根据质量数可知:n(HCl)=n(NaCl)+2n(BaCl2)=2n[Na2CO3]+2n[Ba(OH)2],然后根据V=$\frac{n}{c}$计算出需要加入1mol•L-1盐酸的体积.
解答 解:反应后溶液为中性时,溶质为BaCl2、NaCl,
根据质量守恒可知:n(HCl)=n(NaCl)+2n(BaCl2)=2n[Na2CO3]+2n[Ba(OH)2]=0.1mol/L×0.2L×2+$\frac{1.71g}{171g/mol}$×2=0.06mol,
则需要1mol/L的盐酸的体积为:$\frac{0.06mol}{1mol/L}$=0.06L=60mL,
故选D.
点评 本题考查了物质的量的计算,题目难度不大,明确发生反应实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
16.设阿伏伽德罗常数为NA,则下列说法正确的是( )
| A. | 1.5g甲基(-CH3)所含有的电子数是NA | |
| B. | 14g乙烯和丙烯的混合物中含有原子的数目为NA | |
| C. | 常温常压下,1molCnH2n+2中所含有的共价键数目为(3n+1)NA | |
| D. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4NA |
1.在氯化铁和氯化铜的混合溶液中,加入过量铁粉,完全反应后过滤,所得固体的质量与所加铁粉的质量相等,则原混合液中氯化铁和氯化铜的物质的量浓度之比是( )
| A. | 7:2 | B. | 2:7 | C. | 1:2 | D. | 2:1 |
11.下列关于纤维素的说法不正确的是( )
| A. | 纤维素是白色无臭无味的物质 | |
| B. | 纤维素是不显还原性的物质 | |
| C. | 纤维素不溶于水和一般的有机溶剂 | |
| D. | 纤维素可以发生水解反应,水解的最终产物是麦芽糖 |
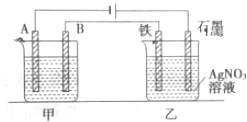
5. 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )| A. | 铁是阳极,电极反应为 Fe-6e-+4H2O=FeO42-+8H+ | |
| B. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| C. | 若隔膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- | |
| D. | 电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计) |
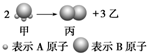 如图所示:已知甲、乙、丙常温下都为气体.
如图所示:已知甲、乙、丙常温下都为气体.