题目内容
10.下列实验设计能完成或实验结论合理的是( )| A. | NH4Cl固体中混有少量的I2,可用加热的方法将I2除去 | |
| B. | 少量浓硝酸保存在无色细口瓶中 | |
| C. | 用浓硫酸吸收二氧化硫中混有少量SO3气体 | |
| D. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
分析 A.加热碘升华,氯化铵分解;
B.硝酸光照分解;
C.浓硫酸可吸收三氧化硫,不易形成酸雾;
D.氯水中含HClO,具有漂白性.
解答 解:A.加热碘升华,氯化铵分解,则加热不能分离,故A错误;
B.硝酸光照分解,则少量浓硝酸保存在棕色细口瓶中,故B错误;
C.浓硫酸可吸收三氧化硫,不易形成酸雾,则用浓硫酸吸收二氧化硫中混有少量SO3气体,故C正确;
D.氯水中含HClO,具有漂白性,则pH试纸不能测定其pH,应选pH计测定,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、试剂的保存、pH的测定为解答的关键,侧重分析与实验能力的考查,注意实验技能及实验的评价性分析,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
10.经测定一瓶气体中只含有C、O两种元素,这瓶气体不可能是( )
| A. | 一种化合物 | B. | 两种酸性氧化物 | ||
| C. | 两种化合物 | D. | 一种单质和一种化合物的混合物 |
1.如表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的是( )
| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A | CuSO4 | FeSO4 | 加入过量铁粉,过滤 |
| B | NaNO3 | CaCO3 | 溶解、过滤 |
| C | CO2 | O2 | 通入NaOH溶液,洗气 |
| D | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
18.请根据你所学过的化学知识,判断下列说法中错误的是( )
| A. | 在使用加酶洗衣粉时先用开水冲泡洗衣粉,这样洗涤效果会增强 | |
| B. | 烧煤时可以加入少量石灰石,防止环境污染 | |
| C. | 氯化钠是家庭常用防腐剂,可用来腌制食品 | |
| D. | 家用水壶积存的水垢的主要成分是Mg(OH)2、CaCO3 |
5.下列叙述正确的是( )
| A. | 铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下铝和浓硫酸、浓硝酸不反应 | |
| B. | 两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多 | |
| C. | 合金的熔点一般比组成它的各成分的熔点都高 | |
| D. | 工业上常利用铝热反应冶炼难熔金属,如钒、铬、锰 |
2.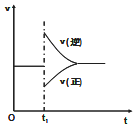 在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:
在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:
2A(g)+B(g)?2C(g)△H<0.达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图.下列对t1时刻改变条件的推测中正确的是( )
 在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:
在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图.下列对t1时刻改变条件的推测中正确的是( )
| A. | 保持压强不变,升高反应温度 | |
| B. | 保持温度不变,增大容器体积 | |
| C. | 保持温度和容器体积不变,充入1 mol C(g) | |
| D. | 保持温度和压强不变,充入1 mol C(g) |
17.过氧化镁(MgO2)为白色粉末,不溶于水,易溶于稀酸,主要用于医药等行业.MgO2可以下反应制得:MgO2+H2O=═MgO2+H2O
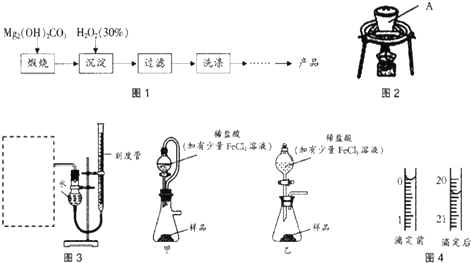
Ⅰ过氧化镁的制备
过氧化镁的制备流程如图1所示:
(1)用如图2所示装置进行煅烧,仪器A的名称是坩埚;
(2)某同学为了研究Mg2(OH)2CO3煅烧条件对合成MgO2的影响.设计实验如下表所示(所取固体质量均为ag),其他条件不变时,探究煅烧温度对合成MgO2的影响,可选择实验①③(填实验编号).
Ⅱ过氧化镁晶体含量的测定:过氧化镁产品中常混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
(3)某同学拟用图3装置测定一定质量的样品中过氧化镁的含量.
①图3装置中,虚线框内应选择装置甲(填“甲”或“乙”).②装置连接完毕后,进行气密性检验的方法为向量气管中加水到右端液面高出左端液面,若液面不发生变化,则气密性良好;③稀盐酸中加入少量FeCl3溶液作用是催化剂.
(4)某同学准确称取1.500g产品于锥形瓶中,加入15ml蒸馏水和15mL2.000mol•L-1 H2SO4,用0.5000mol•L-1KMnO4标准溶液滴定至终点.
反应的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O
①滴定终点观察到的现象为当滴入最后一滴高锰酸钾溶液后溶液由无色变为浅红色,且30s不褪色;
②根据图4计算产品中MgO2的质量分数为95.2%.

Ⅰ过氧化镁的制备
过氧化镁的制备流程如图1所示:
(1)用如图2所示装置进行煅烧,仪器A的名称是坩埚;
(2)某同学为了研究Mg2(OH)2CO3煅烧条件对合成MgO2的影响.设计实验如下表所示(所取固体质量均为ag),其他条件不变时,探究煅烧温度对合成MgO2的影响,可选择实验①③(填实验编号).
| 实验编号 | 煅烧温度(℃) | 煅烧时间(h) |
| ① | 550 | 2 |
| ② | 600 | 1 |
| ③ | 650 | 2 |
| ④ | 700 | 3 |
(3)某同学拟用图3装置测定一定质量的样品中过氧化镁的含量.
①图3装置中,虚线框内应选择装置甲(填“甲”或“乙”).②装置连接完毕后,进行气密性检验的方法为向量气管中加水到右端液面高出左端液面,若液面不发生变化,则气密性良好;③稀盐酸中加入少量FeCl3溶液作用是催化剂.
(4)某同学准确称取1.500g产品于锥形瓶中,加入15ml蒸馏水和15mL2.000mol•L-1 H2SO4,用0.5000mol•L-1KMnO4标准溶液滴定至终点.
反应的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O
①滴定终点观察到的现象为当滴入最后一滴高锰酸钾溶液后溶液由无色变为浅红色,且30s不褪色;
②根据图4计算产品中MgO2的质量分数为95.2%.
18.下列实验设计和结论相符的是( )
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| C. | 某无色溶液加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| D. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中溶液变浑浊,一定有CO32- |