题目内容
16.实验室用Na2CO3固体配制250mL 0.1mol/L的Na2CO3溶液.请填写下列空白:(1)实验时,应用托盘天平称取Na2CO3固体2.7g.
(2)在配制Na2CO3溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、250 mL容量瓶、胶头滴管.
(3)实验中两次用到玻璃棒,其作用分别是搅拌、引流.
(4)若实验过程中遇到下列情况,则会造成所配溶液浓度偏低的有BC.(填序号)
A.转移前,容量瓶中含有少量蒸馏水
B.转移时,有少量溶液溅出
C.定容时,仰视刻度线
D.定容时,俯视刻度线.
分析 (1)依据m=CVM计算溶质的质量;
(2)根据配制一定物质的量浓度溶液一般步骤选择需要的仪器;
(3)溶解固体用玻璃棒搅拌加速固体溶解,移液时用玻璃棒引流;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制250mL 0.1mol/L的Na2CO3溶液,需要碳酸钠的质量m=0.25L×0.1mol/L×106g/mol=2.7g;
故答案为:2.7;
(2)配制250mL 0.1mol/L的Na2CO3溶液一般步骤:计算、称量、溶解、移液、洗涤、定容等,使用的仪器为:托盘天平(带砝码)、药匙、玻璃棒、烧杯、胶头滴管、250 mL容量瓶,所以还缺少:胶头滴管、500 mL容量瓶;
故答案为:250 mL容量瓶;胶头滴管;
(3)溶解固体用玻璃棒搅拌加速固体溶解,移液时用玻璃棒引流;
故答案为:搅拌;引流;
(4)A.转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度无影响,故A错误;
B.转移时,有少量溶液溅出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B正确;
C.定容时,仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故C正确;
D.定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故D错误;
故选:BC.
点评 本题考查了一定物质的量浓度溶液的配制过程中涉及到的仪器的选择和使用等问题,明确配制原理及操作步骤是解题关键,题目难度不大.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
6.常温下,在10mL 0.01mol/L的NaOH溶液中,加入10mL某酸,再滴入紫色石蕊试液,溶液显红色,这种酸可能是( )
| A. | 0.01mol/L CH3COOH溶液 | B. | 0.01mol/L HNO3溶液 | ||
| C. | pH=2的H2SO4溶液 | D. | pH=2的CH3COOH溶液 |
4.下列化合物的俗称与化学式不一致的是( )
| A. | 绿矾一FeSO4•7H2O | B. | 芒硝一Na2SO4•10H2O | ||
| C. | 明矾一Al(SO4)3•12H2O | D. | 胆矾一CuSO4•5H2O |
11. 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( )
 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
1.常温下,将铝投入下列物质中,有H2产生的是( )
| A. | 氢氧化钠溶液 | B. | 食盐水 | C. | 浓硫酸 | D. | 盐酸 |
7.浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓度差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法不正确的是( )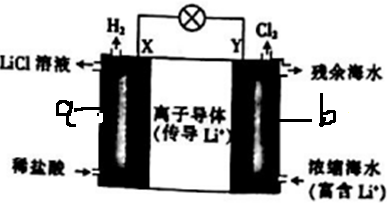

| A. | 电池工作时,Li+通过离子导体移向b区 | |
| B. | 电流由X极通过电路移向Y极 | |
| C. | 正极发生的反应为2H++2e-═H2↑ | |
| D. | Y极每生成1molCl2,a区得到2molLiCl |
4.通过以下反应均可获取H2.下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+206.1kJ•mol-1
③焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)△H3=+131.3kJ•mol-1 .
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+206.1kJ•mol-1
③焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)△H3=+131.3kJ•mol-1 .
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②使用催化剂,△H2减小 | |
| C. | 反应③中反应物的总能量高于生成物的总能量 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8kJ•mol-1 |
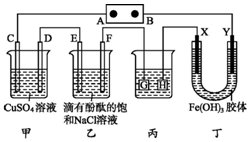 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色. ,砷属于p区元素.
,砷属于p区元素.