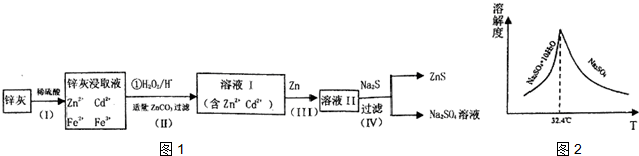
题目内容
18.下列物质的用途利用了其还原性的是( )| A. | 用金属铝进行铝热法炼铁 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用水玻璃制备硅胶和木材防火剂 |
分析 利用还原性,则反应中元素的化合价升高,以此来解答.
解答 解:A.用金属铝进行铝热法炼铁,Al元素的化合价升高,利用Al的还原性,故A选;
B.用熟石灰中和土壤的酸性,为中和反应,无元素的化合价变化,故B不选;
C.用NaHCO3治疗胃酸过多,碳酸氢钠与盐酸发生复分解反应,无元素的化合价变化,故C不选;
D.用水玻璃制备硅胶和木材防火剂,硅酸钠不燃烧、具有防腐作用,与氧化还原反应无关,故D不选;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及元素的化合价变化为解答的关键,侧重分析与应用能力考查,题目难度不大.

练习册系列答案
相关题目
6.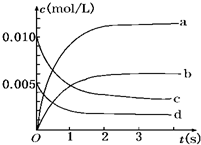 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800℃,反应达到平衡时,NO的物质的量浓度是0.0035mol/L;
(2)图中表示NO2的变化的曲线是b.
(3)用O2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.
(3)用O2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
3.利用海洋资源获得的部分物质如图所示.下列说法正确的是( )
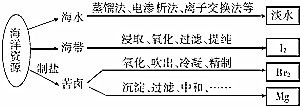

| A. | 从海水中获取淡水,历史最久的方法是离子交换法 | |
| B. | 从海带中获得I2需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等 | |
| C. | 用SO2溶液吸收从苦卤中吹出的单质溴时,发生的离子反应是Br2+SO2+2H2O═4H++SO42-+2Br- | |
| D. | 用石灰石、盐酸等从苦卤中提取镁时,发生反应的反应类型有化合、分解、置换和复分解 |
10.2016年1月1日起,我国已开始施行修订后的《中华人民共和国大气污染防治法》.下列说法错误的是( )
| A. | 开发新能源,减少对化石能源的依赖 | |
| B. | 将燃煤进行脱硫处理,可减少酸雨的形成 | |
| C. | 雾霾(颗粒直径为2.5 x103 nm)具有丁达尔效应 | |
| D. | 推广使用电动汽车,可减少城市雾霾的形成 |
7.某元素的原子序数是34,则该基态原子中电子占据的原子轨道总数为( )
| A. | 17 | B. | 18 | C. | 19 | D. | 20 |
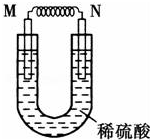 由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.
由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.