题目内容
8.甲酸(HCOOH)熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,具有较强的还原性.加热至160℃即分解成二氧化碳和氢气.(1)实验室中向加热至80℃-90℃的浓硫酸中逐滴滴入甲酸,再缓慢加热可制得一氧化碳:HCOOH$\frac{\underline{\;\;\;\;\;浓硫酸\;\;\;\;\;}}{80℃-90℃}$H2O+CO↑,实验部分装置如图1所示.
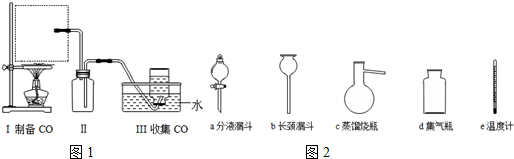
①请从图2中挑选所需的仪器,补充图中虚线方框中缺少的气体发生装置:ac、e(填选项序号)(必要的塞子、玻璃管、橡胶管、固定装置已省略).其中,温度计的水银球应该处于液面以下,但不能接触烧瓶底部位置.
②装置Ⅱ的作用是防止水槽中的水因倒吸流入蒸馏烧瓶中.
(2)实验室可用甲酸、硫酸铜以及碳酸氢钠制备甲酸铜,相关化学方程式为:
2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2•CuCO3+4HCOOH+5H2O═2Cu(HCOO)2•4H2O+CO2↑
实验步骤如下:
Ⅰ、制备碱式碳酸铜:NaHCO3固体,CuSO4•5H2O晶体$→_{研磨}^{i}$ $→_{热水中反应}^{ii}$…→Cu(OH)2•CuCO3固体
①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是研细并混合均匀.
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到出现黑色固体(填写实验现象),说明温度过高.
③步骤ⅱ的后续操作有过滤、洗涤.检验沉淀是否已洗涤干净的方法为:取最后一次洗涤液少许于试管中,滴加滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净;若产生白色沉淀,说明沉淀未洗涤干净.
Ⅱ、制备甲酸铜:
将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的$\frac{1}{3}$时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2~3次,晾干,得到产品.
④“趁热过滤”中,必须“趁热”的原因是防止甲酸铜晶体析出.
⑤用乙醇洗涤晶体的目的是洗去晶体表面的水和其它杂质,并减少甲酸铜晶体的损失.
(3)请设计实验证明甲酸具有较强的还原性:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成,则说明甲酸具有较强的还原性.
分析 (1)①该制备原理符合:液体+液体$\stackrel{△}{→}$气体,且需控制反应的温度,用分液漏斗添加甲酸,在蒸馏烧瓶中反应;
②生成的气体中含有HCOOH,HCOOH易溶于水,B起安全瓶作用;
(2)①研磨使CuSO4•5H2O晶体和NaHCO3固体混合均匀;
②温度过高,碱式碳酸铜会分解生成CuO;
③碱式碳酸铜表面会附着硫酸根离子,用氯化钡溶液检验最后一次洗涤液中是否含有硫酸根离子判断;
④甲酸铜的溶解度随温度的升高而变大,需趁热过滤;
⑤甲酸铜易溶于水,难溶于有机溶剂,洗去晶体表面的水和其它杂质,减少甲酸铜晶体的损失;
(3)甲酸能发生银镜反应,可以证明甲酸具有还原性.
解答 解:(1)①该制备原理符合:液体+液体$\stackrel{△}{→}$气体,用分液漏斗添加甲酸,在蒸馏烧瓶中反应,且需控制反应的温度,温度计水银球应在液面以下,但不能接触烧瓶底部,
故答案为:ac;液面以下,但不能接触烧瓶底部;
②生成的气体中含有HCOOH,HCOOH易溶于水,B起安全瓶作用,防止水因倒吸而流入蒸馏烧瓶中,
故答案为:防止水槽中的水因倒吸流入蒸馏烧瓶中;
(2)①将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是:研细并混合均匀,使反应充分,
故答案为:研细并混合均匀;
②温度过高,碱式碳酸铜会分解生成黑色的CuO,
故答案为:出现黑色固体;
③碱式碳酸铜表面会附着硫酸根离子,检验洗涤干净方法:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净,若产生白色沉淀,说明沉淀未洗涤干净,
故答案为:滴加BaCl2溶液;
④甲酸铜的溶解度随温度的升高而变大,如果冷却,会有晶体析出,降低产率,因此需趁热过滤,防止甲酸铜晶体析出,
故答案为:防止甲酸铜晶体析出;
⑤甲酸铜易溶于水,不能用蒸馏水洗涤,故需用乙醇进行洗涤,洗去晶体表面的水及其它杂质,减少甲酸铜晶体的损失,
故答案为:洗去晶体表面的水和其它杂质,并减少甲酸铜晶体的损失;
(3)甲酸能发生银镜反应,可以证明甲酸具有还原性,具体实验方案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成,
故答案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成,则说明甲酸具有较强的还原性.
点评 本题考查物质制备实验,涉及对装置与操作的分析评价、基本操作、实验方案设计等,是对化学实验综合考查,注意掌握物质制备方案的设计原则.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案| A. | 用金属铝进行铝热法炼铁 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用水玻璃制备硅胶和木材防火剂 |
 常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )
常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )| A. | 相同温度下,电离平衡常K(HX)<K(HY) | |
| B. | b、c两点溶液中水的电离程度相同 | |
| C. | a点溶液中:c(H+)+c(HX)=c(OH-) | |
| D. | b、c两点溶液中Na+的物质的量:nb(Na+)<nc(Na+) |
| A. | M一定是第VIA族元素 | B. | M的最高价氧化物为RO2 | ||
| C. | M的气态氢化物一定能形成氢键 | D. | M的气态氢化物溶于水可能显碱性 |
| A. | 可燃冰是一种清洁能源 | B. | CH4•nH2O是一种离子化合物 | ||
| C. | 可燃冰在常温常压下能稳定存在 | D. | 可燃冰是天然气冷却后得到的固体 |
| A. | 铍的原子失电子能力比镁弱 | |
| B. | Tl(OH)3 和Al(OH)3一样都属于两性氢氧化物 | |
| C. | 硫化氢比硒化氢稳定 | |
| D. | 锂与氧气在点燃的条件下生成氧化锂 |
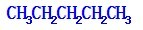 ;
; ;
; .
.