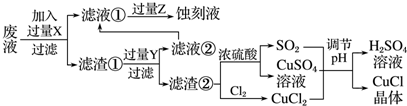
题目内容
14.我国的“神州五号”载人飞船已发射成功,“嫦娥”探月工程已正式启动.据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以42He的形式存在.下列说法正确的是( )| A. | 42He原子核内含有2个质子 | |
| B. | 32He和42He互为同素异形体 | |
| C. | 32He原子核内含有2个中子 | |
| D. | 42He的最外层电子数为4,所以42He具有较强的金属性 |
分析 A.原子符号ZAX,左下角Z代表质子数,左上角A代表质量数,X代表元素符号,其中质量数=质子数+中子数;
B.同素异形体是由同一种元素形成的不同单质;
C.中子数=质量数-质子数,据此计算判断;
D.24He最外层电子数为2.
解答 解:A.原子符号ZAX,左下角Z代表质子数,左上角A代表质量数,X代表元素符号,其中质量数=质子数+中子数,故24He质子数为2,故A正确;
B.同素异形体是由同一种元素形成的不同单质,而23He与24He质子数相同,质量数不同,为氦元素的不同原子,故不是同素异形体,而互为同位素,故B错误;
C.23He中子数为3-2=1,故C错误;
D.24He最外层电子数为2,且为非金属元素,故无金属性,故D错误.
故选A.
点评 本题考查同位素、原子构成中微粒之间关系、原子结构与性质关系等,比较基础,注意基础知识的掌握.

练习册系列答案
相关题目
5.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | Kw/c(OH-)=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32- )=1mol•L-1,则溶液中Na+的个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中c(Na+)=2mol•L-1 |
19.一般来说,轻、薄、疏松、滑爽的织物透气性强,穿在身上轻快凉爽,是夏天普遍采用的衣料,各种丝绸即具有以上特点,那么真丝绸衣服脏了应该选用怎样的洗涤剂( )
| A. | 弱碱性的合成洗涤剂 | B. | 肥皂 | ||
| C. | 中性的合成洗涤剂 | D. | 纯碱 |
6.某实验室制取苯甲酸的过程如下:
(一)如图所示,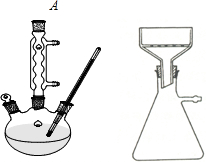
向250mL三颈瓶中加入2.7mL(2.3g)甲苯和100mL水,瓶口装仪器A,加热至沸.从仪器A上口分批加入8.5g高锰酸钾.用少量水(约25mL)将粘在仪器A内壁的高锰酸钾冲洗入烧瓶内.继续煮沸并间歇摇动烧瓶直到甲苯层消失,回流液不再有明显油珠,反应如下:

(二)将反应混合物趁热过滤,用少量热水洗涤滤渣二氧化锰,用玻棒小心搅动(不要使滤纸松动).滤液并倒入400mL烧怀中,将烧杯冷却,然后用浓盐酸酸化,直到苯甲酸全部析出为止;得纯净的苯甲酸质量为1.83g.苯甲酸在不同温度下的溶解度如表:
(1)仪器A的名称是球形冷凝管,(1分)冷却水的进出口方向低进高出
(2)加热前,应先向三颈瓶中加入沸石,其目的是防止暴沸.
(3)反应结束时,溶液还显紫红色,可通过三颈瓶的一个口,向其中加入Na2SO3溶液,发生反应的离子方程式是2MnO4-+3SO32-+H2O=2MnO2+3SO42-+2OH-.(提示:在本实验条件下,高锰酸钾的还原产物是MnO2)
(4)烧杯中的滤液要快速充分冷却,冷却时应将烧杯应放在冷水浴中冷却;然后用浓盐酸酸化,目的是: (用化学方程式表示).
(用化学方程式表示).
(一)如图所示,

向250mL三颈瓶中加入2.7mL(2.3g)甲苯和100mL水,瓶口装仪器A,加热至沸.从仪器A上口分批加入8.5g高锰酸钾.用少量水(约25mL)将粘在仪器A内壁的高锰酸钾冲洗入烧瓶内.继续煮沸并间歇摇动烧瓶直到甲苯层消失,回流液不再有明显油珠,反应如下:

(二)将反应混合物趁热过滤,用少量热水洗涤滤渣二氧化锰,用玻棒小心搅动(不要使滤纸松动).滤液并倒入400mL烧怀中,将烧杯冷却,然后用浓盐酸酸化,直到苯甲酸全部析出为止;得纯净的苯甲酸质量为1.83g.苯甲酸在不同温度下的溶解度如表:
| 温度/℃ | 4 | 18 | 75 |
| 溶解度/[g•(100gH2O)-1] | 0.18 | 0.27 | 2.2 |
(2)加热前,应先向三颈瓶中加入沸石,其目的是防止暴沸.
(3)反应结束时,溶液还显紫红色,可通过三颈瓶的一个口,向其中加入Na2SO3溶液,发生反应的离子方程式是2MnO4-+3SO32-+H2O=2MnO2+3SO42-+2OH-.(提示:在本实验条件下,高锰酸钾的还原产物是MnO2)
(4)烧杯中的滤液要快速充分冷却,冷却时应将烧杯应放在冷水浴中冷却;然后用浓盐酸酸化,目的是:
 (用化学方程式表示).
(用化学方程式表示).
3.下列物质在水中的电离方程式错误的是( )
| A. | NH4HCO3═NH4++HCO3- | B. | Ba(NO3)2═Ba2++2NO3- | ||
| C. | Ca(OH)2═Ca2++(OH)2- | D. | KAl(SO4)2═K++Al3++2SO42- |
4.在25℃,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
①实验1中反应后的溶液中各离子浓度大小关系为:c(K+)>c(A-)>c(OH-)>c(H+);
②实验2反应后的溶液中:c(A-)+c(HA)>0.2mol•L-1(填“>、<、=”).
| 实验编号 | 起始浓度/(mol•L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| 1 | 0.2 | 0.2 | >7 |
| 2 | a | 0.4 | 7 |
②实验2反应后的溶液中:c(A-)+c(HA)>0.2mol•L-1(填“>、<、=”).
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.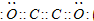 .
.