题目内容
金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是( )
A、铜
| ||||
B、铜
| ||||
C、铜
| ||||
D、铜
|
考点:铜金属及其重要化合物的主要性质,常见的生活环境的污染及治理
专题:元素及其化合物
分析:用铜制取硝酸铜的最佳方法应是:从经济角度出发,制取等量的硝酸铜时,所用的原料最少,成本最低;从环境保护的角度出发,制取硝酸铜时不对环境造成污染.
解答:
解:A.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应生成NO2气体,污染环境,故A不选;
B.Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑,反应生成SO2气体,污染环境,故B不选;
C.反应中使用到了氯气,氯气剧毒,对环保不利,且氯化铜不能与硝酸反应生成硝酸铜,故C不选;
D.2Cu+O2
2CuO,CuO+2HNO3=Cu(NO3)2+H2O,从过程可以看出该过程不会产生有毒气体,环保且没有多消耗原料,不生成污染性气体,故D选;
故选D.
B.Cu+2H2SO4(浓)
| ||
C.反应中使用到了氯气,氯气剧毒,对环保不利,且氯化铜不能与硝酸反应生成硝酸铜,故C不选;
D.2Cu+O2
| ||
故选D.
点评:本题考查了铜和硝酸的性质,主要是生产经济效益,原料的节约利用,反应过程无污染性物质生成.注意制备方案的评价.

练习册系列答案
相关题目
下列各组物质中分子数一定相同的是( )
| A、11.2LH2和0.5molCO2 |
| B、18mLH2O(4℃)和2ⅹ105Pa,27℃32gO2 |
| C、1molCO和88gCO2 |
| D、27℃,22.4LCl2和含4mol氧原子的H2SO4 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、在标准状况下,11.2L 氦气含有NA个氦原子 |
| B、25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| C、11.2L CO含有的分子数为0.5NA |
| D、1mol氧分子含有的电子数与1mol氮气含有的电子数之比为16:7 |
2.16g X2O5中含有0.1mol O,则X的相对原子质量为( )
| A、21.6 | B、28 |
| C、14 | D、31 |
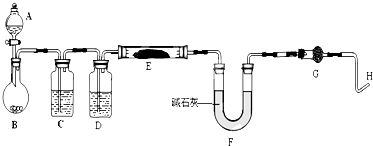
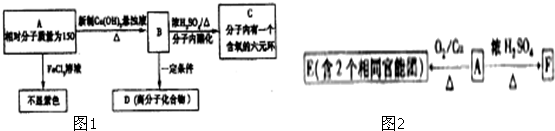

 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: