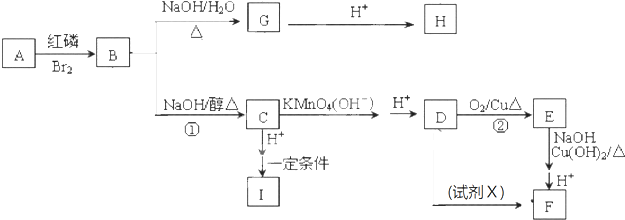
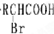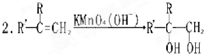题目内容
工业上用CO和H2合成CH3OH:CO(g)+2H2(g)?CH3OH(g).反应的平衡常数如下表:
下列说法正确的是( )
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A、该反应的△H>0 |
| B、加压、增大H2浓度和加入催化剂都能提高CO的转化率 |
| C、工业上采用5×103kPa和250℃的条件,其原因是原料气的转化率高 |
| D、t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100 |
考点:反应热和焓变,化学平衡的影响因素
专题:化学反应中的能量变化
分析:A、依据平衡常数随温度变化和平衡移动原理分析判断;
B、反应前后是气体体积减小的放热反应,增大压强增大氢气浓度,平衡正向进行,催化剂改变反应速率不改变化学平衡;
C、此条件是催化剂活性最大,升温平衡逆向进行;
D、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积.
B、反应前后是气体体积减小的放热反应,增大压强增大氢气浓度,平衡正向进行,催化剂改变反应速率不改变化学平衡;
C、此条件是催化剂活性最大,升温平衡逆向进行;
D、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积.
解答:
解:A、依据平衡常数随温度变化和平衡移动原理分析判断,随温度升高平衡常数减小,正反应为放热反应△H<0,故A错误;
B、反应前后是气体体积减小的放热反应,增大压强增大氢气浓度,平衡正向进行,催化剂改变反应速率不改变化学平衡,不能提高CO的转化率,故B错误;
C、升温平衡逆向进行,此条件是催化剂活性最大,不是原料气的转化率高,故C错误;
D、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.1 0.2 0
变化量(mol/L) 0.1×50% 0.1 0.05
平衡量(mol/L) 0.05 0.1 0.05
平衡常数K=
=100,故D正确;
故选D.
B、反应前后是气体体积减小的放热反应,增大压强增大氢气浓度,平衡正向进行,催化剂改变反应速率不改变化学平衡,不能提高CO的转化率,故B错误;
C、升温平衡逆向进行,此条件是催化剂活性最大,不是原料气的转化率高,故C错误;
D、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.1 0.2 0
变化量(mol/L) 0.1×50% 0.1 0.05
平衡量(mol/L) 0.05 0.1 0.05
平衡常数K=
| 0.05 |
| 0.05×0.12 |
故选D.
点评:本题考查了化学平衡影响因素分析判断,平衡常数概念的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列叙述正确的是( )
| A、自然界中大量存在硅单质 |
| B、石英、水晶、硅石的主要成分都是SiO2 |
| C、自然界中SiO2都存在于石英矿中 |
| D、SiO2表示一个二氧化硅分子由一个硅原子和两个氧原子组成 |
下列有关实验的叙述中,合理的是( )
| A、用25mL碱式滴定管准确量取22.00 mL的KMnO4溶液 |
| B、用广泛pH试纸测出某盐酸溶液的pH为3.2 |
| C、使用pH试纸测定溶液pH时先润湿,则测得溶液的pH都偏小 |
| D、实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度 |
下列变化需要加入氧化剂才能实现的是( )
| A、HCl→H2 |
| B、NaCl→Cl2 |
| C、CuSO4→Cu |
| D、Na2CO3→CO2 |
 用如图所示装置处理含NO3-的酸性工业废水,某电极反应式为2NO3-+12H++10e-=N2+6H2O,则下列说法错误的( )
用如图所示装置处理含NO3-的酸性工业废水,某电极反应式为2NO3-+12H++10e-=N2+6H2O,则下列说法错误的( )| A、电源正极为A,电解过程中有气体放出 |
| B、电解时H+从质子交换膜左侧向右侧移动 |
| C、电解过程中,右侧电解液pH保持不变 |
| D、电解池一侧生成5.6g N2,另一侧溶液质量减少l8g |
阿佛加德罗常数(NA)约为6.02×1023mol-1,下列叙述中正确的是( )
| A、标准状况下,22.4L氯仿(三氯甲烷)中共价键数目为4NA |
| B、标准状况下22.4升CH4和C2H4的混合气体所含氢原子数为4NA |
| C、25℃时,1L pH=1的稀H2SO4中有0.2 NA个H+ |
| D、理论上氢氧燃料电池正极消耗11.2 L标准状况下气体时,外电路通过电子数为NA |
下列各反应的离子方程式中,有错误的是( )
| A、氢氧化铝与盐酸反应:Al(OH)3+3H+═Al3++3H2O |
| B、氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ |
| C、氯化亚铁溶液中滴入氯水:2Fe2++Cl2═2Fe3++2Cl- |
| D、氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O |