题目内容
工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3→2Na3AlF6+3CO2↑+9H2O
完成下列填空:
(1)反应中四种元素对应的简单离子核外电子排布相同,请按离子半径从大到小的顺序排列这这四种离子 ,其中原子序数最大的元素原子核外有 种能量不同的电子,其最外层电子的电子云有 种不同的伸展方向.
(2)反应中有两种元素在元素周期表中位置相邻,能比较它们的金属性或非金属性强弱的事实是 (选填编号).
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(3)反应中两种金属元素,它们的最高价氧化物对应的水化物之间发生反应的离子方程式为 .
(4)冰晶石在工业上可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在 极可得金属铝的质量为 克.
(5)工业上不采用电解氯化铝的方法而是采用电解氧化铝的方法获得铝单质的原因是: .
完成下列填空:
(1)反应中四种元素对应的简单离子核外电子排布相同,请按离子半径从大到小的顺序排列这这四种离子
(2)反应中有两种元素在元素周期表中位置相邻,能比较它们的金属性或非金属性强弱的事实是
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(3)反应中两种金属元素,它们的最高价氧化物对应的水化物之间发生反应的离子方程式为
(4)冰晶石在工业上可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在
(5)工业上不采用电解氯化铝的方法而是采用电解氧化铝的方法获得铝单质的原因是:
考点:微粒半径大小的比较,元素周期律的作用,氧化还原反应
专题:
分析:(1)电子层结构相同,核电荷数越大离子半径越小;原子序数最大的为Al,不同能级中的电子能量不同;最外层为3s23p1,有2种电子云;
(2)反应中两种元素在元素周期表中位置相邻,为O元素与氟元素,可以根据氢化物稳定性、单质与氢气反应难易程度比较,O、F元素没有含氧酸,不能用最高价氧化物对应水化物的酸性,单质与酸反应快慢不能比较非金属性强弱;
(3)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水;
(4)电解池阳极发生氧化反应,阴极发生还原反应,而铝离子发生还原反应,应在阴极析出;根据电子转移守恒计算Al的物质的量,进而计算Al的质量;
(5)氯化铝为共价化合物,晶体中不存在离子,熔融时不能导电.
(2)反应中两种元素在元素周期表中位置相邻,为O元素与氟元素,可以根据氢化物稳定性、单质与氢气反应难易程度比较,O、F元素没有含氧酸,不能用最高价氧化物对应水化物的酸性,单质与酸反应快慢不能比较非金属性强弱;
(3)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水;
(4)电解池阳极发生氧化反应,阴极发生还原反应,而铝离子发生还原反应,应在阴极析出;根据电子转移守恒计算Al的物质的量,进而计算Al的质量;
(5)氯化铝为共价化合物,晶体中不存在离子,熔融时不能导电.
解答:
解:(1)O2-、F-、Na+、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->F->Na+>Al3+;原子序数最大的为Al,核外电子排布为1s22s22p63s23p1,不同能级中的电子能量不同,核外有5种不同能量的电子;最外层为3s23p1,有2种电子云,故答案为:O2->F->Na+>Al3+;5;2;
(2)反应中两种元素在元素周期表中位置相邻,为O元素与氟元素,
a.氢化物越稳定,非金属性越强,故a正确;
b.O、F元素没有含氧酸,不能用最高价氧化物对应水化物的酸性,故b错误;
c.单质与氢气反应越容易,对应元素的非金属性越强,故c正确;
d.单质与同浓度酸发生反应的快慢不能判断非金属性强弱,如氧气与硝酸不反应,而S、碘与硝酸反应,故d错误,
故选:ac;
(3)氢氧化铝是两性氢氧化物,能和氢氧化钠反应,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)电解池阳极发生氧化反应,阴极发生还原反应,而铝离子发生还原反应,应在阴极析出;根据电子转移守恒,析出Al的物质的量为
=0.2mol,故析出Al的质量为0.2mol×27g/mol=5.4g,
故答案为:阴;5.4;
(5)因为氯化铝为共价化合物,属于分子晶体,晶体中不存在离子,熔融时不能导电,故不能被电解;而氧化铝为离子化合物,熔融状态可以导电,
故答案为:因为氯化铝为共价化合物,属于分子晶体,晶体中不存在离子,熔融时不能导电,故不能被电解;而氧化铝为离子化合物,熔融状态可以导电.
(2)反应中两种元素在元素周期表中位置相邻,为O元素与氟元素,
a.氢化物越稳定,非金属性越强,故a正确;
b.O、F元素没有含氧酸,不能用最高价氧化物对应水化物的酸性,故b错误;
c.单质与氢气反应越容易,对应元素的非金属性越强,故c正确;
d.单质与同浓度酸发生反应的快慢不能判断非金属性强弱,如氧气与硝酸不反应,而S、碘与硝酸反应,故d错误,
故选:ac;
(3)氢氧化铝是两性氢氧化物,能和氢氧化钠反应,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)电解池阳极发生氧化反应,阴极发生还原反应,而铝离子发生还原反应,应在阴极析出;根据电子转移守恒,析出Al的物质的量为
| 0.6mol |
| 3 |
故答案为:阴;5.4;
(5)因为氯化铝为共价化合物,属于分子晶体,晶体中不存在离子,熔融时不能导电,故不能被电解;而氧化铝为离子化合物,熔融状态可以导电,
故答案为:因为氯化铝为共价化合物,属于分子晶体,晶体中不存在离子,熔融时不能导电,故不能被电解;而氧化铝为离子化合物,熔融状态可以导电.
点评:本题考查知识较多,涉及微粒半径比较、核外电子排布、元素周期律、离子方程式、电解池原理等,属于拼合型题目,需要学生具备扎实的基础,(2)中b选项为易错点,学生容易忽略O、F没有含氧酸,难度中等.

练习册系列答案
相关题目
常温时,将500mLpH=a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间,测得溶液的pH变为b(假设溶液体积的变化忽略不计),在整个电解过程中始终发现只有一个电极有气体产生.下列说法不正确的是( )
| A、若使溶液恢复到电解前的浓度可以向溶液中加20(10-b-10-a)g CuO |
| B、b<a<7 |
| C、阳极电极反应:4OH--4e-═2O2↑+4H+ |
| D、整个过程中是阳极产生氧气,阴极析出铜单质 |
 双鸭山一中某化学兴趣小组研究酸雨对生铁腐蚀情况的实验如下:图示小试管内为红色的墨水,具支试管中为pH=4.5放置一段时间的雨水和生铁.实验观察到:初期导管内液面下降,后来导管内液面回升,略高于小试管内液面.下列说法正确的是( )
双鸭山一中某化学兴趣小组研究酸雨对生铁腐蚀情况的实验如下:图示小试管内为红色的墨水,具支试管中为pH=4.5放置一段时间的雨水和生铁.实验观察到:初期导管内液面下降,后来导管内液面回升,略高于小试管内液面.下列说法正确的是( )| A、生铁片中的碳是原电池的负极,发生还原反应 |
| B、雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C、墨水回升时,碳电极反应式为O2+2H2O+4e-═4OH- |
| D、具支试管中溶液酸性增强 |
工业上用CO和H2合成CH3OH:CO(g)+2H2(g)?CH3OH(g).反应的平衡常数如下表:
下列说法正确的是( )
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A、该反应的△H>0 |
| B、加压、增大H2浓度和加入催化剂都能提高CO的转化率 |
| C、工业上采用5×103kPa和250℃的条件,其原因是原料气的转化率高 |
| D、t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100 |
X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期.X原子的外围电子排布式为nSnnPn+2.Z原子的核电荷数是最外层电子数的三倍.下列说法正确的是( )
| A、原子序数由大到小的顺序为Z<Y<X |
| B、Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C、3种元素的气态氢化物中Z的气态氢化物最稳定 |
| D、原子半径由大到小的顺序为Z>Y>X |
有两份铝粉,分别投入盐酸中(甲)和氢氧化钠溶液中(乙),在相同条件下产生氢气的体积相等,则甲、乙反应中转移电子的物质的量之比是( )
| A、1:l | B、1:2 |
| C、1:3 | D、1:4 |
设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A、一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA |
B、256g S8分子中含S-S键为7NA个  |
| C、由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| D、1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
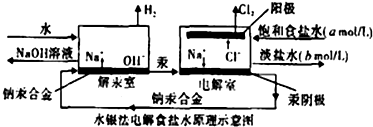 水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如图.下列说法正确的是( )
水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如图.下列说法正确的是( )| A、钠汞合金中钠的化合价为+1价 |
| B、电解室中产生氯气的电极为阳极,产生氢气的电极为阴极 |
| C、当阳极产生3.36 m3(标准状况)Cl2时,解汞室中生成NaOH的质量为24kg |
| D、目前氯碱生产采用离子膜法取代了水银法,其主要原因是汞有毒性,对环境有污染 |
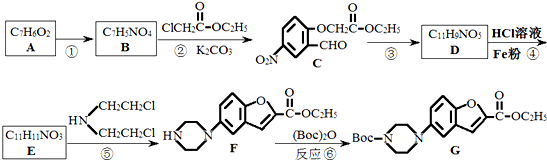
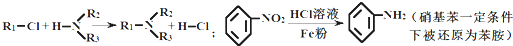
 ,请设计合成路线(无机试剂及溶剂任选).
,请设计合成路线(无机试剂及溶剂任选).