题目内容
8. 乙醇用途广泛,常用作溶剂、饮料、燃料等.
乙醇用途广泛,常用作溶剂、饮料、燃料等.(1)实验测得,1mol液态乙醇在足量氧气中充分燃烧生成二氧化碳和液态水时放出1366.2kJ热量,试写出乙醇燃烧的热化学方程式:CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2 kJ•mol-1.
(2)已知CH2═CH2(g)+H2O(g)→CH3CH2OH(g)△H=-34kJ•
mol-1,则每消耗1g乙烯放出的热量为1.2kJ(保留一位小数).
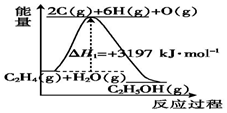
(3)如图为乙烯水化法制乙醇时,化学反应的能量随反应过程的变化.
①乙烯水化法制乙醇时,使用催化剂对该反应的反应热影响是无影响(填“增大”“减小”或“无影响”,下同),对图中△H1的影响是减小.
②已知断裂1mol化学键所需的能量(kJ):H-O键为463、C-C键为347、C-H键为414,C-O键为326,C=C键615.3,则断裂1mol C-O键所需的能量是351.3KJ.
(4)M原子的质子数比硫原子少2个,在25℃、101kPa下,M的最简单气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,该反应的热化学方程式是SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=-1520.0kJ•mol-1.
分析 (1)1mol液态乙醇在足量氧气中充分燃烧生成二氧化碳和液态水时放出1366.2kJ热量,据此书写热化学方程式;
(2)已知CH2═CH2(g)+H2O(g)→CH3CH2OH(g)△H=-34kJ•mol-1,则28gCH2═CH2放出的热量为34kJ•mol-1,故1g乙烯放出的热量为$\frac{1}{28}×34$kJ,据此进行分析;
(3)①催化剂不能改变反应的反应热;催化剂能降低反应的活化能;
②反应中焓变等于反应物中键能之和-生成物中键能之和,以此来解答;
(4)M原子的质子数比硫原子少2个,故M是硅元素,因为SiH4+2O2═SiO2+2H2O~8e-,所以,当有1molSiH4参加反应是,放出热量为190.0kJ×8=1520.0 kJ,故热反应方程式为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=-1520.0 kJ•mol-1,据此进行分析.
解答 解:(1)1mol液态乙醇在足量氧气中充分燃烧生成二氧化碳和液态水时放出1366.2kJ热量,故热化学方程式为CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2 kJ•mol-1,
故答案为:CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2 kJ•mol-1;
(2)已知CH2═CH2(g)+H2O(g)→CH3CH2OH(g)△H=-34kJ•mol-1,则28gCH2═CH2放出的热量为34kJ•mol-1,故1g乙烯放出的热量为$\frac{1}{28}×34$kJ=1.2 kJ,
故答案为:1.2 kJ;
(3)①催化剂不能改变反应的反应热,故使用催化剂对该反应的反应热无影响;催化剂能降低反应的活化能,故对△H1的影响是减小其活化能;
故答案为:无影响;减小;
②设断裂1mol C-O键所需的能量为x,由反应及焓变等于反应物中键能之和-生成物中键能之和可知,
615.3+4×414+2×463-(347+5×414+x+463)=-34,
解得x=351.3,故断裂1mol C-O键所需的能量为351.3,
故答案为:351.3KJ;
(4)M原子的质子数比硫原子少2个,故M是硅元素,因为SiH4+2O2═SiO2+2H2O~8e-,所以,当有1molSiH4参加反应是,放出热量为190.0kJ×8=1520.0 kJ,其热反应方程式为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=-1520.0 kJ•mol-1,
故答案:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=-1520.0 kJ•mol-1.
点评 本题考查热化学方程式的书写,反应热的计算,催化剂的作用,以及利用焓变等于反应物中键能之和-生成物中键能之和求化学键的键能,本题难度中等.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案| A. | 14g氮气含有的原子数为0.5NA | |
| B. | 4 g金属钙变成钙离子时失去的电子数为0.1NA | |
| C. | 1 mol O2分子的质量等于1 mol氧原子的质量 | |
| D. | 16 g O2分子和16g O3分子所含的氧原子数目相等 |
| A. | 5:6 | B. | 6:5 | C. | 3:5 | D. | 5:3 |
| A. | Na+、K+、Cl-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、Ag+、NO3-、HCO3- | D. | Na+、NH4+、CO32-、OH- |
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.8 mol•L-1•s-1 | D. | v (D)=1 mol•L-1•s-1 |
| A. | H3O+的电子式: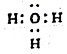 | |
| B. | 氨基的结构式:-NH2 | |
| C. | 乙烷的二氯代物有两种(不考虑立体异构) | |
| D. | NaHS显碱性的原因:HS-+H2O?S2-+H3O+ |