题目内容
6.下列离子方程式书写正确的是( )| A. | 大理石和稀盐酸反应CO32-+2 H+═CO2↑+H2O | |
| B. | 铜和稀硝酸反应3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| C. | 氢氧化钡溶液加入稀硫酸中:OH-+H+═H2O | |
| D. | 铝和烧碱溶液反应 A1+2OH-═A1O2-+H2↑ |
分析 A.碳酸钙为沉淀,应保留化学式;
B.二者反应生成硝酸铜和一氧化氮、水;
C.漏掉钡离子与硫酸根离子的反应;
D.电荷不守恒.
解答 解:A.大理石和稀盐酸反应,离子方程式:CaCO3+2 H+═CO2↑+H2O+Ca2+,故A错误;
B.铜和稀硝酸反应,离子方程式:Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O,故B正确;
C.氢氧化钡溶液加入稀硫酸中,离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C错误;
D.铝和烧碱溶液反应离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故D错误;
故选:B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意离子反应应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
16.1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的.现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序.
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).

(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2L.
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是CH3OH-6e-+8OH-=CO32-+6H2O.
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②2H2(g)+CO2(g)?H2O+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).

(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2L.
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是CH3OH-6e-+8OH-=CO32-+6H2O.
17.降低大气中CO2的含量及有效地开发利用CO2,已引起了各国的普遍重视.工业上用CO、CO2来生产燃料甲醇、乙醇.
(1)图1表示CO(g)和H2(g)生成CH3OH(g)的反应过程中能量的变化(曲线a未使用催化剂,曲线b使用催化剂).写出该条件下该反应的热化学方程式:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol.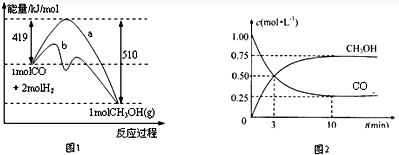
(2)为探究反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的原理,在体积为1L的密闭容器A中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L.min);CO2的转化率为75%.
②该温度下,反应达到平衡时,下列关系式正确的是a(填序号).
a.v正(CO2)=v逆(H2O(g)) b.$\frac{{P}_{起始}}{{P}_{平衡}}$=2 c.v正(H2)=v逆(CO2)d.$\frac{{P}_{起始}}{{P}_{平衡}}$=1.
③该温度下,反应的平衡常数=$\frac{16}{3}$.
④若在体积1L的密闭容器B中,充入2molCO2和6molH2,在与A相同的条件下达到平衡,则两容器中H2的转化率:A容器<B容器(填“<”“>”或“=”).
(3)工业上以CO2和H2为原料合成乙醇:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),在一定压强下,测得的实验数据如下表:
①温度升高,该反应的平衡常数K值减小(填“增大”、“减小”或“不变”).
②表中X的取值范围是33<X<60.
(1)图1表示CO(g)和H2(g)生成CH3OH(g)的反应过程中能量的变化(曲线a未使用催化剂,曲线b使用催化剂).写出该条件下该反应的热化学方程式:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol.

(2)为探究反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的原理,在体积为1L的密闭容器A中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L.min);CO2的转化率为75%.
②该温度下,反应达到平衡时,下列关系式正确的是a(填序号).
a.v正(CO2)=v逆(H2O(g)) b.$\frac{{P}_{起始}}{{P}_{平衡}}$=2 c.v正(H2)=v逆(CO2)d.$\frac{{P}_{起始}}{{P}_{平衡}}$=1.
③该温度下,反应的平衡常数=$\frac{16}{3}$.
④若在体积1L的密闭容器B中,充入2molCO2和6molH2,在与A相同的条件下达到平衡,则两容器中H2的转化率:A容器<B容器(填“<”“>”或“=”).
(3)工业上以CO2和H2为原料合成乙醇:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),在一定压强下,测得的实验数据如下表:
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | X | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
②表中X的取值范围是33<X<60.
14.下列金属冶炼的反应原理,不正确的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | 6MgO+4Al$\frac{\underline{\;\;△\;\;}}{\;}$6Mg+2Al2O3 | ||
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
1.在一定温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | A的生成速率与C分解的速率相等 | |
| B. | 单位时间生成nmolA,同时生成3nmolB | |
| C. | 单位时间生成nmolA,同时生成2nmolC | |
| D. | 单位时间生成B的速率与生成C的速率相等 |
11.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1mol H2O含有的原子数为NA | |
| B. | 4gH2含有氢分子数4NA | |
| C. | 常温常压下,11.2L O2中含有分子数为0.5NA | |
| D. | 1L 0.1 mol•L-1NaCl溶液中含Na+数0.1NA |
18.下列离子方程式书写正确的是( )
| A. | 钠加入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Al2(SO4)3溶液中加入过量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Cl2通入水中 Cl2+H2O?2H++ClO-+Cl- | |
| D. | 向浓盐酸中加二氧化锰:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2H2O+Cl2↑ |
15.金属锰主要用于高级合金的添加剂.以高铁菱锰矿(主要含MnCO3、FeCO3以及钴、镍等碳酸盐杂质、SiO2等)为原料制取金属锰的工艺流程如下:

下表列出了部分化合物的溶度积常数
(1)写出MnCO3溶浸时反应的化学方程式MnCO3+H2SO4=MnSO4+CO2↑+H2O.滤渣Ⅰ的主要成分为SiO2(填化学式).
(2)写出氧化时反应的离子方程式MnO2+4H+2Fe2+=Mn2++2Fe3++2H2O.
(3)加氨水调节溶液的pH至5.0~6.0,滤渣Ⅱ的主要成分为Fe(OH)3(填化学式),若溶液的pH偏高,将会导致溶液中锰元素的含量降低.
(4)若除杂后,溶液中Co2+、Ni2+的浓度均为1.0×10-5 mol•L-1,则c(S2-)最大=10-17mol•L-1.
(5)电解时阴极电极反应式为Mn2++2e-=Mn.

下表列出了部分化合物的溶度积常数
| 物质 | Fe(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 4.0×10-38 | 2.0×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)写出氧化时反应的离子方程式MnO2+4H+2Fe2+=Mn2++2Fe3++2H2O.
(3)加氨水调节溶液的pH至5.0~6.0,滤渣Ⅱ的主要成分为Fe(OH)3(填化学式),若溶液的pH偏高,将会导致溶液中锰元素的含量降低.
(4)若除杂后,溶液中Co2+、Ni2+的浓度均为1.0×10-5 mol•L-1,则c(S2-)最大=10-17mol•L-1.
(5)电解时阴极电极反应式为Mn2++2e-=Mn.
16.关于化学反应 Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO 叙述正确的是( )
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中,每生成1 mol AlN需转移3 mol电子 | |
| C. | AlN中氮元素的化合价为+3价 | |
| D. | AlN的摩尔质量为41 g |