题目内容
14. 将镁条、铝条平行插入盛有一定浓度的NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度的NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )| A. | Mg比Al活泼,Mg失去电子被氧化成Mg2+ | |
| B. | 每生成1molH2,有2mol H2O被还原 | |
| C. | 该电池的内外电路中,电流均是由电子定向移动形成的 | |
| D. | Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
分析 该装置中,铝易失电子作负极,电极反应式为Al+4OH--3e-=AlO2-+2H2O,正极上水得电子发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-,电池反应式为2Al+2NaOH+2H2O=3H2↑+2NaAlO2,内电路中通过离子的定向移动形成电流,
A.金属镁和氢氧化钠溶液不能发生氧化还原反应;
B.根据负极发生反应2H2O+2e-=H2↑+2OH-分析;
C.电池的外电路,是由电子的定向移动形成电流,而内电路,则是由溶液中自由移动的离子的定向移动形成电流;
D.铝离子在过量的碱性溶液中不会产生氢氧化铝沉淀.
解答 解:该装置中,铝易失电子作负极,电极反应式为Al+4OH--3e-=AlO2-+2H2O,正极上水得电子发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-,电池反应式为2Al+2NaOH+2H2O=3H2↑+2NaAlO2,内电路中通过离子的定向移动形成电流,
A.在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,而属镁和氢氧化钠溶液不能发生氧化还原反应,故A错误;
B.负极的电极反应式为2H2O+2e-=H2↑+2OH-,则生成1mol氢气需要还原2mol水,故B正确;
C.该装置外电路,是由电子的定向移动形成电流,而内电路,则是由溶液中自由移动的离子的定向移动形成电流,故C错误;
D.在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,由于电池开始工作时,生成的铝离子的量较少,NaOH过量,此时不会有Al(OH)3白色沉淀生成,故D错误;
故选B.
点评 本题考查原电池工作原理,题目难度不大,明确原电池工作原理为解答关键,注意掌握电池正负极的判断方法,试题培养了学生的灵活应用能力.

①CH3CH2OCH3
②
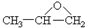
③CH3OOCCH3
④CH3COCH3
⑤CH3CHOHCH3.
| A. | ①③ | B. | ①⑤ | C. | ②④ | D. | ①④ |
| A. | CH3CH2CH2Cl | B. | CH3CHBrCH2Br | C. | CH2BrCH2CH2Br | D. | CH3CHBrCH2CH2Br |
| A. | 用浓硫酸做干燥剂 | |
| B. | 将火柴梗插入浓硫酸中,火柴梗很快变黑 | |
| C. | 铜与浓硫酸加热时发生反应 | |
| D. | 锌与稀硫酸发生置换反应制取氢气 |
| A. | 水、浓H2SO4、洗气 | B. | 饱和NaHCO3溶液、浓H2SO4、洗气 | ||
| C. | 饱和NaCl溶液、浓H2SO4、洗气 | D. | NaOH溶液、浓H2SO4、洗气 |
| A. | 氯水 | B. | 氢氧化钠溶液 | C. | 铜粉 | D. | 铁粉 |
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
②汞不慎洒落地面时,要先用硫磺粉覆盖,使其化合成硫化汞后再妥善处理
③将实验室的废酸与废碱中和后再排放.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
| A. | Cu与Cu20的物质的量之比为2:1 | |
| B. | 硝酸的物质的量浓度为2.4mol/L | |
| C. | 产生的NO在标准状况下的体枳为4.48L | |
| D. | Cu、Cu20与硝酸反应后剩余HN03为lmol |