题目内容
14.某学生为了测定部分变质的Na2SO3样品的纯度,设计了如图实验,回答下列问题:
(1)写出A装置中玻璃仪器的名称:酒精灯圆底烧瓶、分液漏斗.
(2)实验开始后,写出B中反应的离子方程式Cl2+SO2+2H2O═4H++2Cl-+SO42-.
(3)C中的现象是红色鲜花褪色,E装置的作用是吸收未反应的二氧化硫和氯气防止环境污染.
(4)按图2所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应.然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g,则样品中Na2SO3的纯度为50.8%(精确到0.1%)
(5)在过滤沉淀时若滤液出现浑浊,则必须要重复操作,若该学生没有重复过滤,则测定的结果将偏低.
(6)要使测定结果准确,第一:装置气密性必须良好;第二:应先点燃D处酒精灯(填装置字母).
分析 A装置产生二氧化硫,D装置产生氯气在F装置中干燥,C装置检验干燥氯气的漂白性,氯气和二氧化硫在B装置中反应,E装置吸收尾气,防止污染空气.
(1)根据装置图填写仪器名称;
(2)A为实验室制备二氧化硫的发生装置,D为实验室制备氯气的发生装置,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸;
(3)红色鲜花中含水,水和氯气反应生成盐酸和次氯酸,次氯酸具有漂白作用;氯气和二氧化硫有毒,E中NaOH溶液吸收尾气防止污染;
(4)根据图示读取样品质量,托盘天平左物右码,图中砝码和样品放反了,根据硫元素守恒计算,Na2SO3~SO2~BaSO4;
(5)没有重复过滤,导致部分沉淀留在滤液中,导致硫酸钡质量减少;
(6)应先准备氯气,保证二氧化硫被完全氧化.
解答 解:(1)解:装置中所用玻璃仪器为:圆底烧瓶、分液漏斗和酒精灯,故答案为:圆底烧瓶、分液漏斗;
(2)D为实验室制备氯气的发生装置,反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑2H2O,A中是实验室制备二氧化硫的装置,反应的化学方程式为:H2SO4+Na2SO3═Na2SO4+H2O+SO2↑,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
故答案为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
(3))红色鲜花中含水,水和氯气反应生成盐酸和次氯酸,次氯酸具有漂白作用,故红色鲜花褪色;氯气和二氧化硫有毒,二氧化硫在溶液中反应生成亚硫酸钠和水,反应的离子方程式为:SO2+2OH-═SO32-+H2O;氯气在其溶液中反应生成NaCl和NaClO,反应为:Cl2+2OH-═Cl-+ClO-+2H2O,故E中NaOH溶液吸收尾气防止污染,
故答案为:红色鲜花褪色;吸收未反应的二氧化硫和氯气防止环境污染;
(4)根据硫元素守恒计算,
Na2SO3~SO2~BaSO4
126g 233g
m 23.3g
m=$\frac{126g×23.3g}{233g}$=12.6g,
样品质量为:10.0g+10.0g+5.0g-0.2g=24.8g,
所以Na2SO3的质量分数为 $\frac{12.6g}{24.8g}$×100%=50.8%;
故答案为:50.8%;
(5)没有重复过滤,导致部分沉淀留在滤液中,导致硫酸钡质量减少,则由此计算的亚硫酸钠的质量减少,质量分数偏低,故答案为:偏低;
(6)应先准备氯气,保证二氧化硫被完全氧化,故先加热D处酒精灯,故答案为:D.
点评 本题考查实验基本操作、二氧化硫和氯气的性质,题目难度中等,注意从实验目的考虑加热的先后顺序,

 出彩同步大试卷系列答案
出彩同步大试卷系列答案| A. | 常温下,1L0.1mol•L-1CuSO4溶液中含有的Cu2+数目为0.1NA | |
| B. | 含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液NH4+为NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA |
| A. | 两个原子之间的相互作用叫化学键 | |
| B. | 共价化合物中只含有共价键 | |
| C. | 离子化合物中只含有离子键 | |
| D. | 完全由非金属元素形成的化合物一定是共价化合物 |
 卤代烃是一类重要的有机合成中间体,是许多有机合成的原料.根据卤代烃的相关性质,回答下列问题
卤代烃是一类重要的有机合成中间体,是许多有机合成的原料.根据卤代烃的相关性质,回答下列问题



 某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应. .
.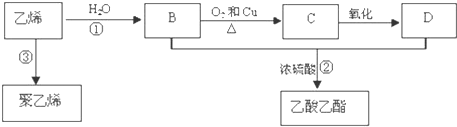
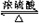 CH3COOC2H5+H2O;③
CH3COOC2H5+H2O;③ .
.
 (1)经分析,某芳香族化合物A含C、H、O的质量分数分别为77.8%、7.4%、14.8%,该有机物一个分子中只含有一个氧原子.
(1)经分析,某芳香族化合物A含C、H、O的质量分数分别为77.8%、7.4%、14.8%,该有机物一个分子中只含有一个氧原子.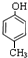 ;
;